Общая информация
Сайт Моя Аптека является современной информационно-справочной платформой, которая помогает найти и сравнить цены на любые товары аптечного ассортимента в аптеках Украины. Это самый простой способ подобрать лекарства по самой низкой цене в ближайшей к Вам аптеке и сэкономить до 20-30% на некоторых покупках.
Просматривайте актуальные цены и наличие необходимого товара в любой аптеке на карте в онлайн формате, бронируйте его всего в несколько шагов и забирайте в удобное время в указанной аптеке.
-
Как забронировать лекарства на сайте Моя Аптека?
Оформить резерв на необходимый товар можно с помощью зеленой кнопки со значком корзинки «Забронировать» на странице товара, на карте или прямо из каталога.
-
Можно ли получить скидку при резервировании?
Да! Наш сервис дает возможность экономить до 30% стоимости от фактической цены в аптеке на те товары, на которые предусмотрена скидка. Сумма скидки указывается при оформлении брони.
-
Как оплатить и получить свой заказ?
Оплата и получение товара осуществляется только в аптеке по адресу, который был выбран при бронировании товара. Моя Аптека дает возможность каждому экономить деньги и время на покупке лекарств.
Сайт mypharmacy.com.ua не предоставляет услуг по доставке/отправке товаров
Экономьте до 30% при бронировании товаров в аптеках.
Бенефикс пор. д/р-ра д/ин. 250 МЕ фл., + Раств. шприц 5 мл, ст. набор №1

Основная информация
Инъекции
рецептурный
Инструкция для Бенефикс пор. д/р-ра д/ин. 250 МЕ фл., + Раств. шприц 5 мл, ст. набор №1
- Состав
- Показания
- Противопоказания
- Способ применения и дозы
- Побочные реакции
- Передозировка
- Применение в период беременности или кормления грудью
- Условия хранения
- Регистрационные данные
Состав
діюча речовина: фактор коагуляції крові людини IX рекомбінантний (нонаког альфа);
1 флакон містить 250 МО або 500 МО, або 1000 МО, або 2000 МО, або 3000 МО нонакогу альфа;
допоміжні речовини: L-гістидин, гліцин, сахароза, полісорбат 80.
Розчинник: 0,234% розчин натрію хлориду у воді для ін’єкцій.
Лікарська форма
Ліофілізат для розчину для ін’єкцій.
Основні фізико-хімічні властивості: ліофілізат білого кольору, практично вільний від чітко видимих сторонніх часток, вологи та дефектів закупорки флакона. Приготований розчин прозорий, безбарвний, практично вільний від видимих часток.
Фармакотерапевтична група
Антигеморагічні засоби. Фактор згортання крові IХ.
Код АТХ В02В D04.
Фармакологічні властивості
Фармакодинаміка.
БенеФікс містить рекомбінантний фактор згортання крові IX (нонаког альфа). Нонаког альфа – очищений білок, що містить 415 амінокислот в одному ланцюгу. Його первинна структура складається з послідовності амінокислот, яка зіставна з Ala148 алельною формою фактора IX, отриманого з плазми крові. Рекомбінантна молекула має деякі пост-трансляційні модифікації, які відмінні від молекули, отриманої з плазми крові. Фактор коагуляції IX рекомбінантний – це глікопротеїн, який секретується генетично модифікованими клітинами, отриманими з лінії клітин яєчників китайського хом’яка. Силу дії (у МО – міжнародних одиницях) визначають, використовуючи метод одноетапного аналізу згортання крові, наведений в Європейській фармакопеї. Питома активність препарату БенеФікс становить не менше 200 МО/мг протеїну.
Рекомбінантний фактор коагуляції IX – це одноланцюговий глікопротеїн з приблизною молекулярною масою 55 кДа, який належить до родини серинових протеаз залежних від вітаміну К факторів згортання. Рекомбінантний фактор згортання крові IX – це білковий препарат, синтезований на основі рекомбінантної ДНК, який має структурні та функціональні характеристики, подібні до характеристик ендогенного фактора IX. Фактор IX активується комплексом фактор VII/тканинний фактор (при реалізації зовнішнього шляху механізму згортання крові) або фактором XIa (при реалізації внутрішнього шляху механізму згортання крові). Активований фактор IX разом із активованим фактором VIII активують фактор X. Це зрештою призводить до перетворення протромбіну на тромбін. Далі тромбін перетворює фібриноген на фібрин, після чого може утворитися тромб. У пацієнтів з гемофілією B активність фактора IX відсутня або значно знижена, тому їм може бути потрібна замісна терапія.
Гемофілія B – це зчеплене зі статтю спадкове порушення згортання крові, обумовлене зниженим рівнем фактора IX, що призводить до спонтанних або зумовлених випадковою чи хірургічною травмою профузних кровотеч у суглоби, м’язи або внутрішні органи. Завдяки замісній терапії рівень фактора IX в плазмі крові підвищуються, що дає змогу тимчасово скоригувати недостатність цього фактора та зменшити схильність до геморагічних явищ.
Аналіз ефективності в дослідженні 3090A1-301-WW ґрунтувався на оцінюванні даних 22 дітей, які перебували на профілактичному режимі, в тому числі 4 дітей, яким змінили лікування за потребою на профілактичне лікування. Двом пацієнтам проводили хірургічні процедури (обрізання та імплантація катетерної порт-системи). Аналіз безпечності, що ґрунтувався на даних 25 пацієнтів, як і очікувалось, підтвердив дані профілю безпечності. Повідомлялося всього про одну зареєстровану тяжку побічну реакцію у вигляді гіперчутливості та розвитку інгібіторів, пов’язану з прийомом препарату БенеФікс, що виникла в єдиного попередньо нелікованого пацієнта (ПНП).
У двох відкритих дослідженнях препарату БенеФікс була продемонстрована безпечність його застосування в дозі 100 МО/кг один раз на тиждень. Проте період напіввиведення препарату (див. розділ «Фармакокінетика») та обмежені дані досліджень фармакокінетики для схеми із застосуванням препарату один раз на тиждень у цілому не дозволяють рекомендувати цю схему для тривалої профілактики в пацієнтів із тяжкою гемофілією B.
Фармакокінетика.
У рандомізованому перехресному дослідженні фармакокінетики, у якому препарат БенеФікс відновлювали за допомогою розчинника — 0,234 % натрію хлориду, було продемонстровано, що його фармакокінетика не відрізняється від фармакокінетики вже представленого на ринку препарату БенеФікс (який відновлювали за допомогою стерильної води) у 24 пацієнтів (віком ≥ 12 років), які раніше отримували лікування препаратом у дозі 75 МО/кг. Крім того, фармакокінетичні показники відстежували в 23 із цих пацієнтів після багаторазового застосування препарату БенеФікс протягом шести місяців, і було встановлено, що вони не відрізняються від показників вихідної оцінки. Зведені дані оцінки фармакокінетики наведені в Таблиці 1.
Таблиця 1
Розраховані значення фармакокінетичних показників для препарату БенеФікс (75 МО/кг) на вихідному рівні та через 6 місяців у пацієнтів із гемофілією B, які раніше отримували лікування
|
Показник |
Вихідний рівень n = 24 |
Місяць 6 n = 23 |
|
Cmax (МО/дл) |
54,5 ± 15,0 |
57,3 ± 13,2 |
|
AUC∞ (МО•год/дл) |
940 ± 237 |
923 ± 205 |
|
t1/2 (год) |
22,4 ± 5,3 |
23,8 ± 6,5 |
|
Кліренс (мл/год/кг) |
8,47 ± 2,12 |
8,54 ± 2,04 |
|
Відновленння |
0,73 ± 0,20 |
0,76 ± 0,18 |
|
AUC∞ – площа під фармакокінетичною кривою «концентрація в плазмі крові–час» від початку відліку часу до нескінченності; Cmax – максимальна концентрація; t1/2 – період напіввиведення з плазми крові. |
||
Було розроблено фармакокінетичну модель популяції, що враховувала зібрані дані 73 пацієнтів віком від 7 місяців до 60 років. Параметри, що оцінювалися з використанням кінцевої двокамерної моделі, наведено в таблиці 2. Порівнюючи з дорослими та підлітками, у немовлят і дітей кліренс вищий, об'єм розподілу більший, період напіввиведення коротший і відновлення нижче. Заключна фаза однозначно не охоплювалася через брак даних (за час понад добу) у дітей віком до 6 років.
Таблиця 2.
Середнє значення ± стандартне відхилення фармакокінетичних показників на основі індивідуальних баєсових правил оцінювання з аналізу популяційної фармакокінетики
|
Вікова група (роки) |
Діти < 2 |
Діти від 2 до < 6 |
Діти від 6 до < 12 |
Діти від 12 до < 18 |
Дорослі від 18 до 60 |
|
Кількість пацієнтів |
7 |
16 |
1 |
19 |
30 |
|
Кліренс (мл/год/кг) |
13,1 ± 2,1 |
13,1 ± 2,9 |
15,5 |
9,2 ± 2,3 |
8,0 ± 0,6 |
|
Vрівн (мл/кг) |
252 ± 35 |
257 ± 25 |
303 |
234 ± 49 |
225 ± 59 |
|
Період напіввиведення (год) |
15,6 ± 1,2 |
16,7 ± 1,9 |
16,3 |
21,5 ± 5,0 |
23,9 ± 4,5 |
|
Відновлення (МО/дл на МО/кг) |
0,61 ± 0,10 |
0,60 ± 0,08 |
0,47 |
0,69 ± 0,16 |
0,74 ± 0,20 |
Показания
Лікування та профілактика кровотеч у пацієнтів з гемофілією B (вроджений дефіцит фактора IX).
БенеФікс можна застосовувати всім віковим групам.
Противопоказания
Препарат протипоказаний пацієнтам з гіперчутливістю до діючої речовини або до будь-якої з допоміжних речовин, а також пацієнтам з підвищеною чутливістю до білків хом’яка.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Повідомлень про взаємодію препаратів фактора коагуляції крові людини IX (рекомбінантної ДНК) з іншими медичними препаратами не надходило.
Особливості застосування
Гіперчутливість.
Препарат БенеФікс може спричинити реакції гіперчутливості алергічного типу. Препарат містить слідові кількості білків хом’яка. При застосуванні препаратів, що містять фактор IX, в тому числі препарату БенеФікс, спостерігались випадки розвитку потенційно небезпечних для життя анафілактичних/анафілактоїдних реакцій. Пацієнтам слід негайно припинити застосування препарату та звернутися до лікаря у разі появи симптомів гіперчутливості. Пацієнтам необхідно повідомляти про ранні ознаки розвитку реакцій гіперчутливості: утруднене дихання, задишку, набряки, звичайну та генералізовану кропив'янку, свербіж, відчуття стиснення у грудях, бронхоспазм, ларингоспазм, дихання зі свистом, артеріальну гіпотензію, нечіткість зору і анафілаксію.
У деяких випадках такі реакції прогресують до тяжкої анафілаксії. У разі розвитку шоку слід дотримуватись чинних медичних стандартів щодо лікування цього стану. У разі виникнення тяжких алергічних реакцій необхідно розглянути питання щодо використання альтернативних гемостатичних методів.
Інгібітори.
Утворення інгібіторів у ПЛП, які отримують препарати, що містять фактор IX, спостерігається нечасто. Оскільки в ході клінічних досліджень у одного ПЛП, що отримував БенеФікс, було виявлено клінічно значуще утворення інгібіторів, що супроводжувалося недостатньою відповіддю пацієнта на лікування, а також враховуючи, що досвід вивчення антигенних властивостей рекомбінантного фактора IX все ще обмежений, слід ретельно контролювати стан пацієнтів, яким призначається препарат БенеФікс щодо утворення інгібіторів фактора IX. Титр інгібіторів у одиницях Бетезда визначають за допомогою належних біологічних методів тестування.
Опубліковані дані свідчать про наявність кореляції між утворенням інгібіторів фактора IX та розвитком алергічних реакцій. Тому пацієнтів, у яких спостерігалися алергічні реакції на препарат, слід обстежити на присутність інгібіторів. Необхідно відзначити, що пацієнти, у яких утворились інгібітори фактора IX, можуть мати підвищений ризик розвитку анафілаксії у відповідь на введення фактора IX. Попередні дані вказують на можливий взаємозв'язок між наявністю значних мутацій за типом делеції у гені, що кодує синтез фактора IX і підвищеним ризиком утворення інгібіторів та розвитком гострих реакцій гіперчутливості до препарату. Необхідний ретельний нагляд за пацієнтами зі значними мутаціями за типом делеції у гені, що кодує синтез фактора IX, щодо виникнення симптомів гострих реакцій підвищеної чутливості, особливо на початкових етапах використання препарату.
Враховуючи наявність ризику виникнення алергічних реакцій на концентрати фактора IX, перше застосування препарату БенеФікс, згідно з призначенням лікаря, необхідно проводити під медичним наглядом із забезпеченням доступності необхідних засобів лікування алергічних реакцій.
Тромбоз.
Хоча БенеФікс містить лише фактор IX, необхідно враховувати ризик розвитку тромбозу і дисемінуючого внутрішньосудинного згортання крові (ДВЗ-синдрому). Оскільки застосування комплексних концентратів з фактором IX історично асоціюється з розвитком тромбоемболічних ускладнень, застосування препаратів, що містять фактор IX, може бути потенційно небезпечним для пацієнтів з ознаками фібринолізу та для пацієнтів з ДВЗ-синдромом. З огляду на потенційний ризик розвитку тромботичних ускладнень, при застосуванні цього препарату пацієнтам із захворюваннями печінки, після оперативного втручання, новонародженим, пацієнтам з підвищеним ризиком тромботичних подій або з ДВЗ-синдромом необхідний клінічний нагляд щодо наявності ранніх ознак розвитку тромботичних ускладнень та коагулопатії споживання з використанням належних біологічних методів тестування. У кожній із цих ситуацій необхідно оцінити співвідношення користі від лікування препаратом БенеФікс та ризику розвитку таких ускладнень.
Безпечність та ефективність застосування препарату БенеФікс шляхом безперервної інфузії не були встановлені. У період постмаркетингового нагляду застосування фактору коагуляції крові людини IX були отримані повідомлення про випадки розвитку тромботичних ускладнень, в тому числі небезпечного для життя синдрому верхньої порожнистої вени (ВПВ) у тяжкохворих новонароджених, на фоні застосування препарату БенеФікс шляхом безперервної інфузії через центральний венозний катетер (див. розділ «Побічні реакції»).
Серцево-судинні явища.
У пацієнтів з факторами ризику розвитку серцево-судинних захворювань замісна терапія із застосуванням фактора IX може збільшити такий ризик.
Нефротичний синдром.
У пацієнтів з гемофілією В та інгібіторами фактора IX і алергічними реакціями в анамнезі повідомлялося про випадки розвитку нефротичного синдрому після спроби проведення терапії методом індукції імунної толерантності. Безпечність та ефективність застосування препарату БенеФікс для індукції імунної толерантності не встановлені.
Особливі групи пацієнтів.
У клінічних дослідженнях щодо застосування препарату БенеФікс попередньо нелікованим пацієнтам не отримано достатньої кількості даних.
Нотування інформації про використання.
Настійно рекомендується кожного разу при введенні пацієнту препарату БенеФікс записувати назву та номер серії лікарського засобу для того, щоб зберегти інформацію про те, яку саме серію препарату було введено певному пацієнту. Можна прикріпити одну з відривних етикеток з флакона, щоб задокументувати номер серії у щоденнику пацієнта, для повідомлення у разі можливого виникнення будь-яких побічних ефектів.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
БенеФікс не впливає на здатність керувати автотранспортом та використовувати інші механізми.
Способ применения и дозы
Лікування слід проводити під наглядом лікаря з досвідом лікування гемофілії.
Моніторинг лікування.
Протягом курсу лікування рекомендується проводити дослідження рівня фактора IX для визначення необхідної дози та частоти повторних інфузій. Різні пацієнти можуть реагувати по-різному на введення фактора IX, що проявляється в різних періодах напіввиведення та рівнях відновлення. Розрахунок дози за масою тіла для пацієнтів із недостатньою або надмірною вагою може потребувати коригування. У разі серйозних хірургічних втручань ретельний моніторинг замісної терапії шляхом аналізу коагуляції (активності фактора IX у плазмі) є обов’язковим.
Якщо для визначення активності фактора IX у плазмі в зразках крові пацієнтів використовується метод аналізу одноетапної коагуляції на основі тромбопластинового часу (aPTT) in vitro, на результати аналізу можуть у значній мірі впливати як тип реагента aPTT, так і стандартний зразок, які використовувались. Цей факт слід особливо враховувати у разі зміни лабораторії та/або реагентів, які використовуються для проведення аналізу.
Дозування.
Дозування препарату і тривалість замісної терапії залежать від ступеня недостатності фактора IX, локалізації і тяжкості кровотечі, а також від клінічного стану пацієнта.
Кількість введених одиниць фактора IX зазначають в МО, пов’язаних з діючим стандартом ВООЗ для препаратів, що містять фактор IX. Активність фактора IX у плазмі крові зазначається у відсотках (відносно нормальної людської плазми) або у міжнародних одиницях (відносно міжнародного стандарту для фактору IX у плазмі).
1 МО активності фактора IX еквівалентна кількості фактора IX в 1 мл нормальної людської плазми.
Лікування за вимогою.
Розрахунок необхідної дози препарату БенеФікс базується на емпіричних даних про те, що 1 одиниця активності фактора IX на 1 кг маси тіла повинна підвищувати рівень фактора IX у крові в середньому на 0,8 МО/дл (у межах від 0,4 до 1,4 МО/дл) у пацієнтів віком від 12 років (подальша інформація у розділі «Фармакокінетика»).
Необхідна доза розраховується за такою формулою:
необхідна кількість одиниць фактора IX (МО) =
маса тіла (кг) × бажане збільшення кількості фактора IX (% або МО/дл) × зворотна величина поступового відновлення, яке зазвичай спостерігається після інфузії фактора;
для відновлення на рівні 0,8 МО/дл (середнє підвищення фактора IX) використовують таку формулу:
необхідна кількість одиниць фактора IX (МО) =
маса тіла (кг) × бажане збільшення кількості фактора IX (% або МО/дл) × 1,3 МО/кг.
Для визначення дози й частоти введення препарату слід завжди враховувати клінічну ефективність у кожному окремому випадку.
У разі виникнення геморагічних явищ активність фактора IX у плазмі крові не повинна падати нижче наведених у таблиці 3 рівнів (у % або у МО/дл) у відповідний період. Наведену нижче таблицю можна використовувати як настанову для визначення дозування препарату при кровотечах та хірургічному втручанні.
Таблиця 3
|
Тяжкість кровотечі/ тип хірургічного втручання |
Необхідний рівень фактора IX (% від нормального або МО/дл плазми) |
Частота введення (години)/ Тривалість терапії (дні) |
|
Кровотеча |
||
|
Початкові ознаки гемартрозу, крововиливів у м’язи або кровотечі у ротовій порожнині |
20 – 40 |
Введення повторювати кожні 24 години щонайменш протягом 1 дня до припинення кровотечі, про що свідчить відсутність болю або наявність загоювання |
|
Гемартрози та м’язові кровотечі середнього ступеня тяжкості або гематоми |
30 – 60 |
Введення повторювати кожні 24 години протягом 3–4 днів або довше до зникнення болю та відновлення рухливості кінцівок |
|
Кровотечі, що загрожують життю |
60 – 100 |
Введення повторювати кожні 8–24 години до зникнення загрози життю |
|
Хірургічні втручання |
||
|
Незначні хірургічні втручання, включаючи видалення зуба |
30 – 60 |
Введення повторювати кожні 24 години, щонайменш протягом 1 дня, до загоювання |
|
Значні хірургічні втручання |
80 – 100 (до та після хірургічного втручання) |
Введення повторювати кожні 8–24 години до адекватного загоювання рани, потім продовжувати терапію протягом щонайменше 7 днів для підтримання активності фактора IX на рівні 30–60% (МО/дл) |
Профілактика.
БенеФікс можна застосовувати для тривалої профілактики геморагічних явищ пацієнтам з тяжкою формою гемофілії B. У клінічному дослідженні середня доза препарату для звичайної вторинної профілактики у ПЛП становила 40 МО/кг (від 13 до 78 МО/кг) з інтервалами введення від 3 до 4 днів.
У деяких випадках, особливо в пацієнтів молодого віку, може виникнути потреба в скороченні інтервалів між введенням препарату або у збільшення дози.
Пацієнти літнього віку
Кількість пацієнтів віком від 65 років, які брали участь у клінічних дослідженнях препарату БенеФікс, не є достатньою, аби визначити різницю в реакції на препарат цієї категорії пацієнтів порівняно з пацієнтами молодшого віку. Дозу препарату БенеФікс для пацієнтів старшого віку, як і для решти пацієнтів, потрібно визначати індивідуально.
Спосіб застосування
БенеФікс вводять шляхом внутрішньовенної інфузії після приготування розчину для ін’єкцій із використанням стерильного 0,234% розчину натрію хлориду.
БенеФікс слід вводити повільно. У більшості випадків швидкість інфузії не перевищує 4 мл/хв. Швидкість введення визначається ступенем комфорту пацієнта.
У разі виникнення реакції гіперчутливості, яка може бути пов’язана із застосуванням препарату БенеФікс, необхідно зменшити швидкість інфузії або взагалі припинити її (див. розділи «Особливості застосування» та «Побічні реакції»).
Аглютинація еритроцитів у системі для внутрішньовенного краплинного введення/шприці.
Були отримані повідомлення про випадки аглютинації еритроцитів у системі для внутрішньовенного краплинного введення/шприці на фоні застосування препарату БенеФікс. Не повідомлялося про жодні клінічні наслідки, пов’язані з цим спостереженням. Для мінімізації ймовірності аглютинації важливо обмежити кількість крові, що потрапляє в систему для внутрішньовенного краплинного введення, і виключити потрапляння крові в шприц. Якщо спостерігається аглютинація еритроцитів у системі для внутрішньовенного краплинного введення/шприці, усі використовувані для введення препарату матеріали (систему для внутрішньовенного краплинного введення, шприц і розчин БенеФікс) слід утилізувати та продовжити введення препарату з нової упаковки.
Безперервна інфузія.
Введення препарату шляхом безперервної інфузії не затверджено та не рекомендується (див. розділ «Особливості застосування»).
За допомогою стерильного адаптера готують розчин ліофілізованого порошку у розчиннику, що додається у попередньо наповненому шприці. Флакон слід обережно повертати до повного розчинення порошку. Попередньо порошок та розчинник необхідно нагріти до кімнатної температури. Отриманий розчин набирають назад у шприц. Розчин повинен бути прозорим та безбарвним. Розчин слід утилізувати, якщо спостерігаються включення чужорідних часточок або зміна кольору.
Розчин препарату БенеФікс містить полісорбат 80, який має здатність прискорювати екстракцію ди-(2-етилгексил)фталату з полівінілхлориду (ПВХ). Дану особливість необхідно враховувати при приготуванні та застосуванні препарату.
Приготування розчину
1. Доведіть температуру ліофілізату та розчинника у попередньо наповненому шприці до кімнатної температури.
2. Зніміть пластикову flip-top кришку з флакона препарату БенеФікс, щоб відкрити центральну частину гумової пробки.
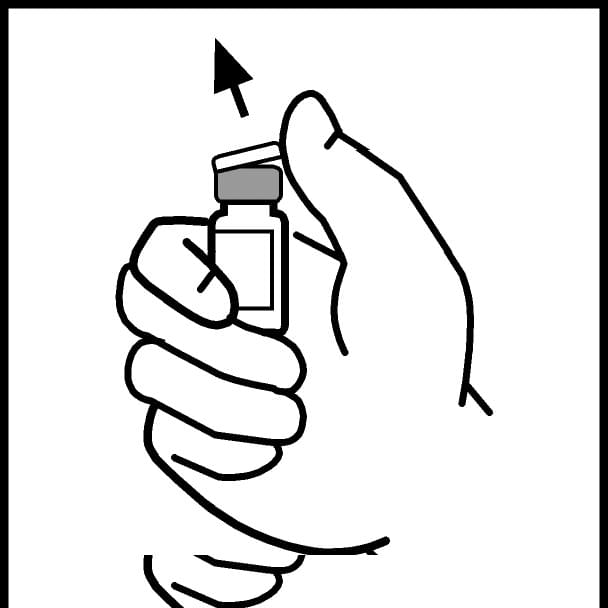
3. Протріть верхню частину флакона тампоном зі спиртом, що додається до упаковки, або використайте інший антисептичний розчин та дайте висохнути. Після очищення не торкайтеся руками гумової пробки та не допускайте, щоб вона торкалася будь-яких поверхонь.
4. Відігніть захисне покриття прозорої пластикової упаковки адаптера до флакона. Не виймайте адаптер з упаковки.
5. Поставте флакон на рівну поверхню. Тримаючи упаковку з адаптером, насадіть адаптер на флакон. Сильно натисніть так, щоб адаптер з клацанням зайняв своє місце на верхній частині флакона, а вістря адаптера пройшло крізь пробку флакона.
6. Зніміть упаковку з адаптера та утилізуйте її.
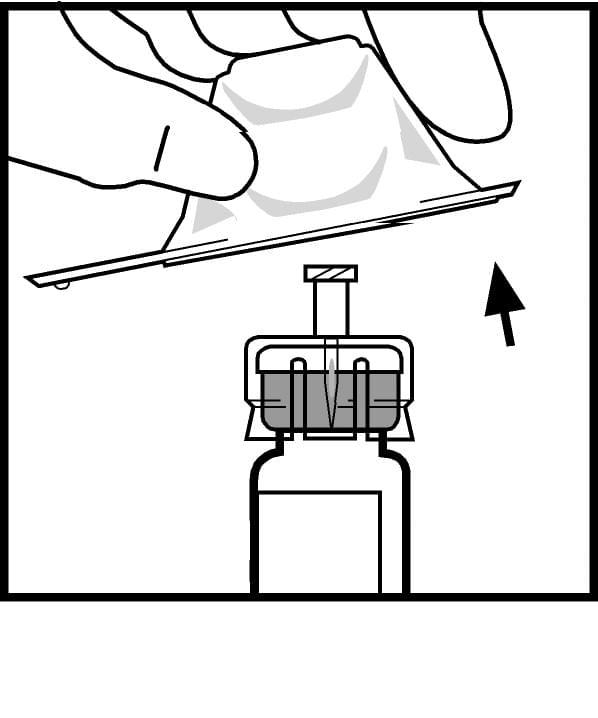
7. Приєднайте шток поршня до шприца з розчинником: вставте шток в отвір у стопері шприца, сильно натискайте та прокручуйте шток, поки він не ввійде надійно у стопер.
8. Відламайте пластиковий ковпачок-насадку з індикатором першого відкриття зі шприца з розчинником, порушивши цілісність перфорації на ковпачку. Це роблять, розхитуючи ковпачок доти, доки перфорація не буде зламана. Не торкайтеся внутрішньої поверхні ковпачка або кінчика шприца. Може виникнути необхідність надіти ковпачок назад (якщо приготований розчин препарату не буде використаний негайно), тому відкладіть його, поставивши отвором догори.
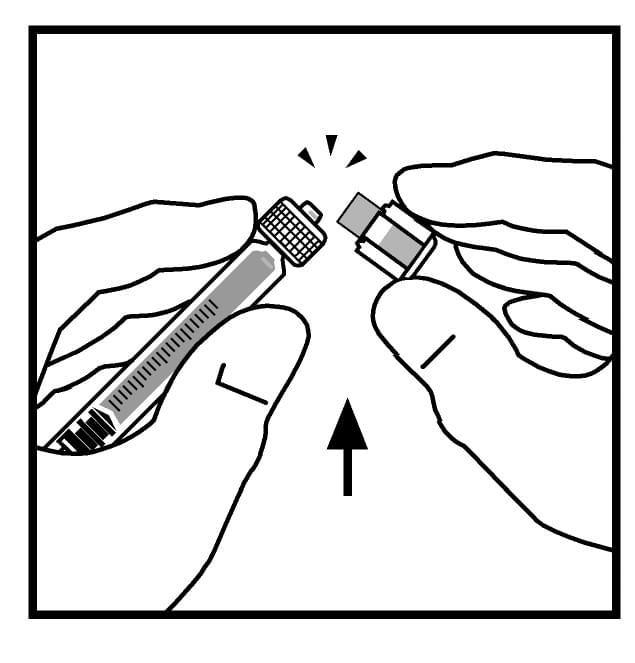
9. Поставте флакон на рівну поверхню. Приєднайте шприц з розчинником до адаптера флакона, вставляючи наконечник шприца у отвір адаптера, сильно натискаючи та прокручуючи шприц за ходом годинника до отримання надійного з’єднання.
10. Повільно натисніть на шток поршня, щоб ввести весь розчинник у флакон з препаратом.
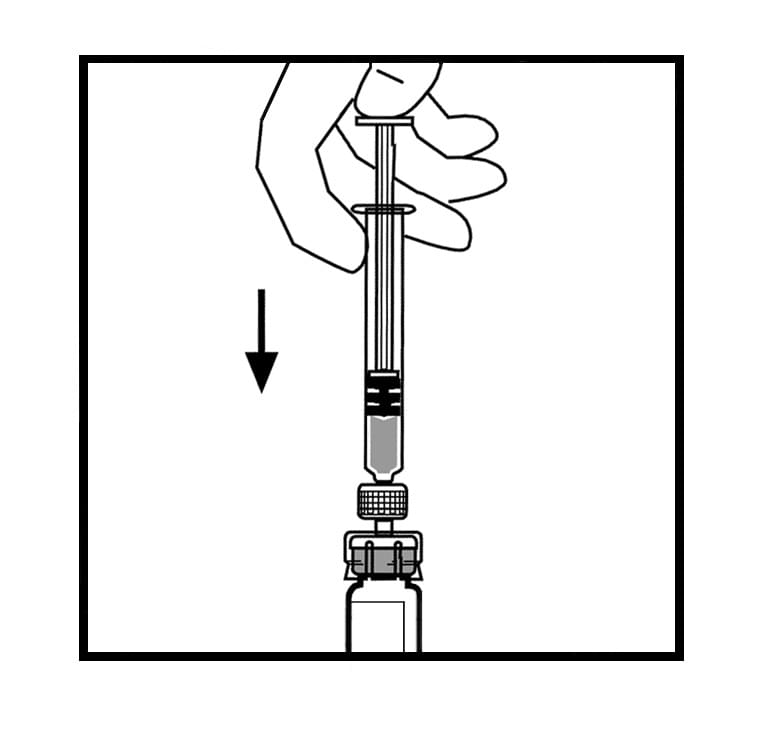
11. Залишаючи шприц приєднаним до адаптера, обережно обертайте флакон до повного розчинення порошку.
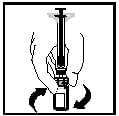
12. Перед застосуванням приготований розчин слід візуально перевірити щодо наявності сторонніх часток. Отриманий розчин повинен бути прозорим або злегка опалесцентним та безбарвним.
Якщо використовується більше одного флакона препарату БенеФікс на інфузію, кожний флакон слід готувати згідно з попередніми інструкціями. Далі шприц для розчинника слід видалити, залишаючи адаптер до флакона на місці, а для відбору розчину з кожного флакона можна використовувати один великий шприц з замком Люера.
13. Впевнившись, що поршень залишається повністю введеним в циліндр шприца, переверніть флакон. Повільно витягніть увесь розчин через адаптер флакона у шприц.
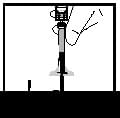
14. Від’єднайте шприц від адаптера флакона, обережно відтягуючи та прокручуючи шприц проти годинникової стрілки. Викиньте флакон з приєднаним адаптером.
Якщо розчин не буде використано негайно, ковпачок шприца слід обережно повернути на місце. Не слід торкатися кінчика шприца або внутрішньої поверхні ковпачка.
Приготовлений розчин слід використати одразу або протягом 3 годин після приготування розчину за умови зберігання при температурі не вище 25 °С.
Застосування (внутрішньовенна ін’єкція)
БенеФікс слід вводити, використовуючи попередньо наповнений розчинником шприц, що додається, або стерильний одноразовий пластиковий шприц з замком Люера. Для відбору розчину з флакона необхідно використовувати адаптер.
Слід утилізувати невикористаний розчин, порожній флакон(-и) та використані голки та шприци у відповідному контейнері для утилізації медичних відходів, оскільки ці матеріали можуть зашкодити іншим, якщо не будуть утилізовані належним чином.
Діти.
Існує обмежена інформація щодо лікування за необхідності та хірургічних втручань у дітей віком до 6 років, які отримують лікування препаратом БенеФікс.
Середня доза (± стандартне відхилення) для профілактики становила 63,7 (± 19,1) МО/кг з інтервалами від 3 до 7 днів. Для пацієнтів молодшого віку може виникнути необхідність скоротити інтервали між введенням або збільшити дози. Кількість застосованого фактора IX для звичайної профілактики у 22 пацієнтів у дослідженні становила 4607 (± 1849) МО/кг на рік і 378 (± 152) МО/кг на місяць.
Для необхідної корекції дози рекомендується відповідно до клінічних показань проводити ретельний моніторинг активності фактора IX, а також розрахунок фармакокінетичних параметрів (таких як час напіввиведення та рівень відновлення).
Побочные реакции
Резюме з безпеки.
Спостерігались реакції гіперчутливості або алергічні реакції (серед яких можуть бути ангіоневротичний набряк, відчуття печіння та поколювання в місці інфузії, озноб, гіперемія обличчя, звичайна та генералізована кропив'янка, головний біль, артеріальна гіпотензія, летаргія, нудота, неспокій, тахікардія, відчуття стиснення в грудній клітці, шум або дзвін у вухах, блювання, дихання зі свистом), які в деяких випадках можуть прогресувати до тяжкої анафілаксії, включаючи шок. Іноді ці реакції прогресували до тяжкої анафілаксії та розвивалися у тісному часовому зв’язку з утворенням інгібіторів фактора IX (див. розділ «Особливості застосування»). Повідомлялось про нефротичний синдром, який виникав після спроби індукції імунної толерантності в пацієнтів із гемофілією В з інгібіторами фактора IX і алергічними реакціями в анамнезі.
Дуже рідко спостерігалося утворення антитіл до білків хом’яка із супутніми реакціями гіперчутливості.
У пацієнтів із гемофілією В можуть утворюватися нейтралізуючі антитіла (інгібітори) до фактора IX. Утворення інгібіторів може проявлятися у вигляді недостатньої клінічної відповіді. У таких випадках рекомендується звернутися до спеціалізованого центру з лікування гемофілії.
Існує ризик тромбоемболічних епізодів після введення препаратів із фактором IX (див. розділ «Особливості застосування»).
Перелік побічних реакцій.
Наведена нижче таблиця відповідає класифікації «Система–орган–клас» MedDRA. Частота визначається таким чином: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), нечасто (від ≥ 1/1000 до < 1/100), невідомо (неможливо встановити, виходячи з наявних даних). У таблиці 4 наведено побічні реакції, які спостерігалися протягом клінічних досліджень у раніше лікованих пацієнтів та які були виявлені під час застосування препарату після його виходу на ринок. Частота ґрунтується на всіх терапевтично обумовлених невідкладних побічних реакціях з об’єднаних клінічних досліджень у 224 пацієнтів.
У межах кожної групи побічні ефекти зазначені у порядку зменшення їх серйозності.
Таблиця 4
|
Система–орган–клас |
Дуже часто
|
Часто
|
Нечасто
|
Невідомо
|
|
Інфекції та інвазії |
|
|
Запалення підшкірної клітковини в місці інфузіїа |
|
|
З боку системи крові та лімфатичної системи |
|
|
Пригнічення фактора IXб |
|
|
З боку імунної системи |
|
Гіперчутливістьв |
|
Анафілактична реакція* |
|
З боку нервової системи |
Головний більг |
Запаморочення, дисгевзія |
Сонливість, тремор |
|
|
З боку органів зору |
|
|
Погіршення зоруґ |
|
|
З боку серця |
|
|
Тахікардіяд |
|
|
З боку судин |
|
Флебіт, гіперемія обличчяе |
Артеріальна гіпотензіяє |
Синдром верхньої порожнистої вениж,*, тромбоз*, тромбофлебіт* |
|
З боку дихальної системи, органів грудної клітки та середостіння |
Кашельз |
|
|
|
|
З боку шлунково-кишкового тракту |
|
Нудота; блювання
|
|
|
|
З боку шкіри та підшкірної тканини |
|
Висипанняи, кропив’янка |
|
|
|
З боку нирок і сечовидільної системи |
|
|
Інфаркт ниркиі |
|
|
Загальні розлади та реакції в місці введення |
Пірексія |
Дискомфорт в ділянці грудної кліткий, реакція в місці інфузіїк, біль у місці інфузіїл |
|
Недостатня відповідь на лікування* |
|
Дослідження |
|
|
|
Недостатній рівень відновлення фактора IXм,* |
|
* Побічні реакції, виявлені після виходу препарату на ринок. а У тому числі запалення підшкірної клітковини. б Утворення тимчасових інгібіторів із низьким титром. в У тому числі реакції гіперчутливості до лікарських засобів, ангіоневротичний набряк, бронхоспазм, дихання зі свистом, диспное й ларингоспазм. г У тому числі мігрень і синусний головний біль. ґ У тому числі мерехтлива скотома і нечіткість зору. д У тому числі посилене серцебиття і синусна тахікардія. е У тому числі припливи, відчуття жару та підвищення температури шкіри. є У тому числі зниження артеріального тиску. ж Синдром верхньої порожнистої вени в новонароджених із критичними захворюваннями під час отримання безперервної інфузії БенеФіксу через центральний венозний катетер. з У тому числі продуктивний кашель. и У тому числі макулярні, папульозні та макулопапульозні висипання. і Стався в серопозитивного пацієнта з гепатитом С через 12 днів після введення дози препарату БенеФікс під час епізоду кровотечі. й У тому числі біль в місці ін’єкції, дискомфорт у місці інфузії. к У тому числі свербіж у місці інфузії та еритема в місці інфузії. л У тому числі біль і відчуття стискання в грудях. м Буквальний термін. MedDRA 17.1 PT не було отримано. |
||||
Реакції гіперчутливості / алергічні реакції.
У разі виникнення реакції гіперчутливості, яка може бути пов’язана із застосуванням препарату БенеФікс, див. розділ «Особливості застосування» вище.
Утворення інгібіторів.
Утворення інгібіторів, що мало клінічне значення та проявлялося недостатньою відповіддю на лікування, було виявлено у 1 пацієнта з 65, які отримували БенеФікс (включаючи 9 пацієнтів, які брали участь лише у хірургічному дослідженні) та раніше лікувалися препаратами, виготовленими з плазми крові. Цей пацієнт зміг продовжити лікування препаратом БенеФікс без повторного збільшення інгібіторів або розвитку анафілаксії (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
Діти.
У дітей алергічні реакції можуть виникати частіше, ніж у дорослих.
Для того щоб надати інформацію щодо частоти утворення інгібіторів у ПНП, даних недостатньо (див. розділ «Фармакодинаміка»).
Повідомлення про підозрювані побічні реакції.
Після реєстрації лікарського засобу дуже важливо повідомляти про підозрювані побічні реакції. Це дає змогу продовжувати тривалий нагляд за співвідношенням користі та ризику лікарського засобу. Медичні працівники повинні повідомляти про будь-які підозрювані побічні реакції.
Передозировка
Про симптоми передозування, пов’язані з препаратами рекомбінантного фактора коагуляції крові людини IX, не повідомлялось.
Применение в период беременности или кормления грудью
Дослідження з впливу фактору ІХ на репродуктивну функцію тварин не проводилися. Оскільки гемофілія В рідко виникає у жінок, досвід застосування фактора ІХ в період вагітності та годування груддю відсутній. Тому фактор ІХ слід застосовувати жінкам в період вагітності та годування груддю лише за нагальної потреби.
Вплив препарату на фертильність не визначено.
Условия хранения
Термін придатності
Для ліофілізату – 2 роки.
Для розчинника – 4 роки.
Умови зберігання
Зберігати в оригінальній упаковці в недоступному для дітей місці при температурі від 2 до 30°С. Не заморожувати, щоб уникнути пошкодження попередньо наповненого шприца.
Приготовлений розчин слід використати одразу або протягом 3 годин після приготування розчину за умови зберігання при температурі не вище 25 °С.
Несумісність
Препарат не можна змішувати з іншими лікарськими засобами, включаючи інші інфузійні розчини. Для введення препарату можна використовувати лише набір для інфузій, що входить у комплект, оскільки нонаког альфа може адсорбуватися на внутрішніх поверхнях іншого інфузійного обладнання.
Упаковка
1 флакон з ліофілізатом, 1 попередньо наповнений шприц з розчинником, 1 адаптер для флакону, 1 систему для інфузії, 2 тампони зі спиртом, 1 пластир, 1 марлеву подушечку вкладають у картонну коробку.
Категорія відпуску
За рецептом.
Регистрационные данные
Инструкция для: Бенефикс пор. д/р-ра д/ин. 250 МЕ фл., + Раств. шприц 5 мл, ст. набор №1
Производитель: Вает Фарма С.А. для "Пфайзер Эйч. Си. Пи. Корпорейшн", Испания / США
Фарм. группа: Антигеморрагические средства. Фактор свертывания крови IX.
Регистрация: 873/12-300200000
Код АТХ:
(B) Лекарственные средства, влияющие на кроветворение и кровь
(B02) Противгеморрагические средства
(B02B) Витамин K и другие гемостатики
(B02BD) Фактор свертывания крови
(B02BD04) Фактор свертывания крови IX




Отзывы о Бенефикс пор. д/р-ра д/ин. 250 МЕ фл., + Раств. шприц 5 мл, ст. набор №1
По этому товару ещё нет отзывов