Загальна інформація
Сайт Моя Аптека є сучасною інформаційно-довідниковою платформою, яка допомагає знайти і порівняти ціни на будь-які товари аптечного асортименту в аптеках України. Це найпростіший спосіб підібрати ліки за найнижчою ціною в найближчій до Вас аптеці і заощадити до 20-30% на деяких покупках.
Переглядайте актуальні ціни та наявність необхідного товару в будь-якій аптеці на карті в онлайн форматі, бронюйте його всього в кілька кроків і забирайте в зручний час у зазначеній аптеці.
-
Як забронювати ліки на сайті Моя Аптека?
Оформити резерв на необхідний товар можна за допомогою зеленої кнопки із позначкою кошика «Забронювати» на сторінці товару, на карті або прямо з каталогу.
-
Чи можна отримати знижку при резервуванні?
Так! Наш сервіс дає можливість економити до 30% вартості від фактичної ціни в аптеці на ті товари, на які передбачена знижка. Сума знижки вказується при оформленні броні.
-
Як оплатити і отримати своє замовлення?
Оплата і отримання товару здійснюється тільки в аптеці за адресою, який був обраний при бронюванні товару. Моя Аптека дає можливість кожному економити гроші і час на покупці ліків.
Сайт mypharmacy.com.ua не надає послуг по доставці/відправленні товарів
Економте до 30% при бронюванні товарів в аптеках.
Офев капсули м`як. по 150 мг №60 (10х6)
Основна інформація
онкологія
онкологія
Таблетки і капсули
для дорослих
рецептурний
Інструкція для Офев капсули м`як. по 150 мг №60 (10х6)
- Склад
- Показання
- Протипоказання
- Спосіб застосування та дози
- Побічні реакції
- Передозування
- Застосування у період вагітності або годування груддю
- Умови зберігання
- Реєстраційні данні
Склад
діюча речовина: нінтеданіб;
1 капсула містить 100 мг або 150 мг нінтеданібу (у вигляді езилату);
допоміжні речовини: тригліцериди середньоланцюгові, твердий жир, лецитин (соєвий)
(Е 322);
оболонка капсули: желатин, гліцерин 85%, титану діоксид (Е 171), заліза оксид червоний (Е 172), заліза оксид жовтий (Е 172);
чорнило чорного кольору для маркування капсул: шелак, етанол, пропіленгліколь (Е 1520), заліза оксид чорний (E 172).
Лікарська форма
Капсули м’які.
Основні фізико-хімічні властивості:
ОФЕВ, капсули м’які по 100 мг
Продовгуваті непрозорі м’які желатинові капсули персикового кольору, з одного боку чорним чорнилом нанесений логотип компанії «Boehringer Ingelheim» і маркування «100».
Капсули містять в’язку суспензію яскраво-жовтого кольору.
ОФЕВ, капсули м’які по 150 мг
Продовгуваті непрозорі м’які желатинові капсули коричневого кольору, з одного боку чорним чорнилом нанесений логотип компанії «Boehringer Ingelheim» і маркування «150».
Капсули містять в’язку суспензію яскраво-жовтого кольору.
Фармакотерапевтична група
Антинеопластичні засоби. Інгібітори протеїнкінази.
Код ATХ L01X E31.
Фармакологічні властивості
Фармакодинаміка.
Механізм дії
Нінтеданіб є низькомолекулярним інгібітором тирозинкінази, який блокує рецептори, у тому числі рецептор фактора росту тромбоцитів (PDGFR) α та β, рецептор фактора росту фібробластів (FGFR) 1-3 і рецептор фактора росту ендотелію судин (VEGFR) 1-3. Крім того, нінтеданіб інгібує кінази Lck (лімфоцит-специфічна білкова тирозинкіназа), Lyn (білкова тирозинкіназа lyn), Src (протоонкогенна білкова тирозинкіназа src) та CSF1R (рецептор колонієстимулюючого фактора 1). Нінтеданіб конкурентно взаємодіє з аденозинтрифосфат (АТФ)-зв’язуючою ділянкою цих кіназ і блокує внутрішньоклітинну передачу каскадних сигналів які продемонстрували, що вони беруть участь у патогенезі ремоделюванні фіброзної тканини при інтерстиціальних захворюваннях легенів.
Фармакодинамічні ефекти
У дослідженняхin vitro з використанням клітин людини було встановлено, що нінтеданіб інгібує процеси, залучені до ініціації фіброзного патогенезу, вивільнення профіброзних медіаторів з моноцитарних клітин периферичної крові та поляризації макрофагів до альтернативно активованих макрофагів. Було встановлено, що нінтеданіб пригнічує фундаментальні процеси у фіброзі органів, проліферації та міграції фібробластів, а також перетворенні на активний фенотип міофібробластів та секреції позаклітинного матриксу. У дослідженнях на тваринах у кількох моделях ІЛФ, СС/ІЗЛ-СС, ІЗЛ, обумовленої ревматоїдним артритом (РА), та фіброзів інших органів нінтеданіб продемонстрував протизапальну та антифібротичну дію у легенях, шкірі, серці, нирках та печінці. Нінтеданіб також виявив судинну активність. Він знижував дермальний мікросудинний апоптоз ендотеліальних клітин та послаблював ремоделювання легеневих судин за рахунок зменшення проліферації гладком'язових клітин судин, товщини стінок легеневих судин та частки закупорених легеневих судин.
Клінічна ефективність та безпека
Ідіопатичний легеневий фіброз (ІЛФ)
Клінічна ефективність нінтеданібу вивчалася у пацієнтів з ІЛФ в рамках двох рандомізованих подвійних сліпих плацебо-контрольованих досліджень фази ІІІ з однаковим дизайном (INPULSIS-1 (1199.32) та INPULSIS-2 (1199,34)). Пацієнти з вихідним розрахунковим значенням ФЖЄЛ < 50 % або дифузною здатністю за монооксидом вуглецю (ДЗМВ, з поправкою на гемоглобін) < 30 %, розрахованою на вихідному рівні, були виключені із дослідження. Пацієнти були рандомізовані у співвідношенні 3:2 до групи препарату ОФЕВ 150 мг або групи плацебо із прийомом препарату двічі на добу упродовж 52 тижнів.
Первинною кінцевою точкою був річний показник скорочення форсованої життєвої ємності легенів (ФЖЄЛ). Ключовими вторинними кінцевими точками були зміна загального балу за анкетою лікарні Святого Георгія для оцінки дихальної функції (SGRQ) на 52-му тижні відносно вихідних значень, а також час до першого загострення ІЛФ.
Річний показник скорочення ФЖЄЛ
Річний показник скорочення ФЖЄЛ (у мл) продемонстрував суттєве зниження у пацієнтів, які отримували нінтеданіб, порівняно з тими, хто отримував плацебо. Лікувальний ефект був подібним в обох дослідженнях (див. табл. 1).
Таблиця 1.
Річний показник скорочення ФЖЄЛ у дослідженнях INPULSIS-1, INPULSIS-2 та зведені дані в рамках популяції пацієнтів, що пройшли лікування
|
Дослідження |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 та INPULSIS-2 Зведені дані |
|||
|
Лікування |
Плацебо |
ОФЕВ 150 мг двічі на добу |
Плацебо |
ОФЕВ 150 мг двічі на добу |
Плацебо |
ОФЕВ 150 мг двічі на добу |
|
Кількість пацієнтів, дані яких були проаналізовані |
204 |
309 |
219 |
329 |
423 |
638 |
|
Показник1 (SE) скорочення за 52 тижні |
−239,9 |
−114,7 |
−207,3 |
−113,6 |
−223,5 |
−113,6 |
|
(18,71) |
(15,33) |
(19,31) |
(15,73) |
(13,45) |
(10,98) |
|
|
Порівняння з плацебо |
||||||
|
Різниця1 |
|
125,3 |
|
93,7 |
|
109,9 |
|
95% ДІ |
|
(77,7, |
|
(44,8, |
|
(75,9, |
|
172,8) |
142,7) |
144,0) |
||||
|
p-величина |
|
<0,0001 |
|
0,0002 |
|
<0,0001 |
|
1 Оцінено на основі регресійної моделі з випадковими коефіцієнтами. ДІ - довірчий інтервал SE - стандартна похибка |
В аналізі чутливості, який дав змогу припустити, що у пацієнтів, дані яких відсутні на 52-му тижні, скорочення ФЖЄЛ після останнього зафіксованого значення є аналогічним показникам скорочення, зафіксованим у всіх пацієнтів, які приймали плацебо, скоригована різниця в річному показнику скорочення ФЖЄЛ між нінтеданібом та плацебо склала 113,9 мл/рік (95% ДІ 69,2, 158,5) у дослідженні INPULSIS-1 та 83,3 мл/рік (95% ДІ 37,6, 129,0) у дослідженні INPULSIS-2.
На рис. 1 продемонстровано процес зміни в часі відносно вихідного значення в обох групах лікування, що ґрунтується на узагальненому аналізі даних, отриманих в ході досліджень INPULSIS-1 та INPULSIS-2.
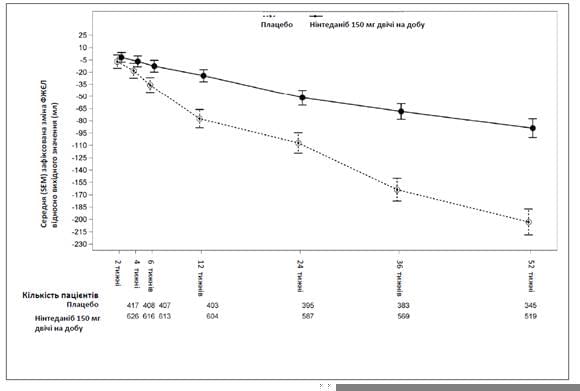
Рис. 1. Середня (SEM) зафіксована зміна ФЖЄЛ в часі відносно вихідного значення (мл), зведені дані досліджень INPULSIS-1 та INPULSIS-2
Аналіз даних пацієнтів, що відповіли на лікування з точки зору показника ФЖЄЛ
В обох дослідженнях INPULSIS відсоток пацієнтів, що відповіли на лікування з точки зору показника ФЖЄЛ, до категорії яких були включені пацієнти, у яких абсолютне розрахункове скорочення ФЖЄЛ у % не перевищило 5% (граничне значення, що вказує на підвищення ризику смертності при ІЛФ), був значно вищим в групі нінтеданібу, ніж у групі плацебо. Аналогічні результати спостерігалися при аналізі із використанням традиційного граничного значення на рівні 10% (див. табл. 2).
Таблиця 2.
Відсоток пацієнтів, що відповіли на лікування з точки зору показника ФЖЄЛ на 52-му тижні у дослідженнях INPULSIS-1, INPULSIS-2 та зведені дані в рамках популяції пацієнтів, що пройшли лікування
|
Дослідження |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 та INPULSIS-2, зведені дані |
|||
|
Лікування |
Плацебо |
ОФЕВ, 150 мг двічі на добу |
Плацебо |
ОФЕВ, 150 мг двічі на добу |
Плацебо |
ОФЕВ, 150 мг двічі на добу |
|
Кількість пацієнтів, дані яких були проаналізовані |
204 |
309 |
219 |
329 |
423 |
638 |
|
5% граничне значення |
||||||
|
Кількість (%) пацієнтів, що відпо-віли на лікування з точки зору показника ФЖЄЛ1 |
78 (38,2) |
163 (52,8) |
86 (39,3) |
175 (53,2) |
164 (38,8) |
338 (53,0) |
|
У порівнянні з плацебо |
||||||
|
Співвідношення шансів |
1,85 |
1,79 |
1,84 |
|||
|
95% ДІ |
(1,28, 2,66) |
(1,26, 2,55) |
(1,43, 2,36) |
|||
|
p-величина2 |
0,0010 |
0,0011 |
<0,0001 |
|||
|
10% граничне значення |
||||||
|
Кількість (%) пацієнтів, що відповіли на лікування з точки зору показника ФЖЄЛ1 |
116 (56,9) |
218 (70,6) |
140 (63,9) |
229 (69,6) |
256 (60,5) |
447 (70,1) |
|
У порівнянні з плацебо |
||||||
|
Співвідношення шансів |
1,91 |
1,29 |
1,58 |
|||
|
95% ДІ |
(1,32, 2,79) |
(0,89, 1,86) |
(1,21, 2,05) |
|||
|
p-величина2 |
0,0007 |
0,1833 |
0,0007 |
|||
1Пацієнти, що відповіли на лікування - це хворі з абсолютним скороченням ФЖЄЛ не більше ніж на 5 або 10% від розрахункового значення ФЖЄЛ у %, залежно від граничного значення, з оцінкою ФЖЄЛ на 52-му тижні.
2На основі логістичної регресії.
Час до прогресування захворювання (абсолютне скорочення розрахункового значення ФЖЄЛ у % на ≥ 10% або смерть)
В обох дослідженнях INPULSIS було продемонстровано клінічно значуще зниження ризику прогресування захворювання у пацієнтів, що отримували лікування нінтеданібом, у порівнянні із плацебо. У зведеному аналізі показник співвідношення ризиків склав 0,60, вказуючи на 40 % зниження ризику прогресування захворювання у пацієнтів, що отримували лікування нінтеданібом, у порівнянні із плацебо.
Таблиця 3.
Відсоток пацієнтів з абсолютним скороченням розрахункового значення ФЖЄЛ у % на ≥ 10% або смертю (явища) за період 52 тижні та час до прогресування захворювання у дослідженнях INPULSIS-1, INPULSIS-2 і зведені дані в рамках популяції пацієнтів, що пройшли лікування
|
Дослідження |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 та INPULSIS-2, зведені дані |
|||
|
Лікування |
Плацебо |
ОФЕВ 150 мг двічі на добу |
Плацебо |
ОФЕВ 150 мг двічі на добу |
Плацебо |
ОФЕВ 150 мг двічі на добу |
|
Кількість пацієнтів в групі ризику |
204 |
309 |
219 |
329 |
423 |
638 |
|
Пацієнти з явищами, N (%) |
83 |
75 |
92 |
98 |
175 |
173 |
|
(40,7) |
(24,3) |
(42,0) |
(29,8) |
(41,4) |
(27,1) |
|
|
Порівняння з плацебо1 |
||||||
|
p-величина2 |
0,0001 |
0,0054 |
<0,0001 |
|||
|
Співвідношення ризиків3
|
0,53
|
0,67 |
0,60 |
|||
|
95% ДІ |
(0,39, 0,72) |
(0,51, 0,89) |
(0,49, 0,74) |
|||
|
1 На основі даних, зібраних за період до 372 днів (52 тижні+ 7 днів). 2 На основі логарифмічного рангового критерію. 3 На основі регресійної моделі Кокса. |
Зміна загального бала SGRQ на 52-му тижні відносно вихідних значень
У зведеному аналізі досліджень INPULSIS базові показники SGRQ становила 39,51 у групі нінтеданібу та 39,58 у групі плацебо, розрахункова середня зміна загального бала SGRQ на 52-му тижні відносно вихідних значень була меншою в групі нінтеданібу (3,53), ніж в групі плацебо (4,96), з різницею між групами лікування на рівні -1,43 (95% ДІ: -3,09, 0,23; p=0,0923). Загалом, вплив нінтеданібу на пов’язану зі здоров’ям якість життя, що вимірюється на основі загального балу SGRQ, є незначним та демонструє менше погіршення порівняно із плацебо.
Час до першого загострення ІЛФ
У зведеному аналізі досліджень INPULSIS у пацієнтів, які отримували нінтеданіб, спостерігався чисельно менший ризик першого загострення, порівняно з тими, хто приймав плацебо (див. табл. 4).
Таблиця 4.
Відсоток пацієнтів із загостреннями ІЛФ (явища) за період 52 тижні та час до першого загострення на основі даних, повідомлених дослідником, у дослідженнях INPULSIS-1, INPULSIS-2 і зведені дані в рамках популяції пацієнтів, що пройшли лікування
|
Дослідження |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 та INPULSIS-2, зведені дані |
|||
|
Лікування |
Плацебо |
ОФЕВ 150 мг двічі на добу |
Плацебо |
ОФЕВ 150 мг двічі на добу |
Плацебо |
ОФЕВ 150 мг двічі на добу |
|
Кількість пацієнтів в групі ризику |
204 |
309 |
219 |
329 |
423 |
638 |
|
Пацієнти з явищами, N (%) |
11 (5,4) |
19 (6,1) |
21 (9,6) |
12 (3,6) |
32 (7,6) |
31 (4,9) |
|
Порівняння з плацебо1 |
||||||
|
p-величина2 |
0,6728 |
0,0050 |
0,0823 |
|||
|
Співвідношення ризиків3
ризиків3 |
1,15 |
0,38 |
0,64 |
|||
|
95% ДІ |
(0,54, 2,42) |
(0,19, 0,77) |
(0,39, 1,05) |
|||
|
1 На основі даних, зібраних за період до 372 днів (52 тижні+ 7 днів). 2 На основі логарифмічного рангового критерію. 3 На основі регресійної моделі Кокса. |
Аналіз чутливості показав, що відсоток пацієнтів, які мали принаймні 1 випадок загострення, що пройшов експертну оцінку, протягом 52 тижнів, був нижчим у групі нінтеданібу (1,9% пацієнтів), ніж у групі плацебо (5,7% пацієнтів). В аналізі часу до настання оціненого випадку загострення із використанням зведених даних було виведено значення співвідношення ризиків (HR) на рівні 0,32 (95% ДІ 0,16, 0,65; p=0,0010). Це вказує на те, що ризик виникнення першого загострення ІЛФ був статистично значуще нижчим у групі нінтеданібу, ніж у групі плацебо в будь-який момент часу.
Аналіз виживаності
У зведеному аналізі даних виживаності за попередньо визначеними змінними в рамках досліджень INPULSIS загальна смертність за 52-тижневий період була нижчою у групі нінтеданібу (5,5%), ніж в групі плацебо (7,8%). В аналізі часу до смерті було визначено значення HR - 0,70 (95% ДІ 0,43, 1,12; p=0,1399). Результати усіх кінцевих точок за параметром «виживаність» (таких як смертність в процесі лікуванні та смертність від респіраторних явищ) продемонстрували переконливу чисельну різницю на користь нінтеданібу.
Таблиця 5.
Смертність з усіх причин (явища) за період 52 тижні у дослідженнях INPULSIS-1,
INPULSIS-2 і зведені дані в рамках популяції пацієнтів, що пройшли лікування
|
Дослідження |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 та INPULSIS-2, зведені дані |
|||
|
Лікування |
Плацебо |
ОФЕВ 150 мг двічі на добу |
Плацебо |
ОФЕВ 150 мг двічі на добу |
Плацебо |
ОФЕВ 150 мг двічі на добу |
|
Кількість пацієнтів в групі ризику |
204 |
309 |
219 |
329 |
423 |
638 |
|
Пацієнти з явищами, N (%) |
13 (6,4) |
13 (4,2) |
20 (9,1) |
22 (6,7) |
33 (7,8) |
35 (5,5) |
|
Порівняння з плацебо1 |
||||||
|
p-величина2 |
0,2880 |
0,2995 |
0,1399 |
|||
|
Співвідношення ризиків3 |
0,63 |
0,74 |
0,70 |
|||
|
95% ДІ |
(0,29, 1,36) |
(0,40, 1,35) |
(0,43, 1,12) |
|||
|
1 На основі даних, зібраних за період до 372 днів (52 тижні+ 7 днів). 2 На основі логарифмічного рангового критерію. 3 На основі регресійної моделі Кокса. |
Додаткові дані, отримані у дослідженні фазиIVINJOURNEY, в якому застосовували ОФЕВ у дозі 150 мг двічі на добу та пірфенідон як додаткову терапію:
Супутнє лікування нінтеданібом і пірфенідоном вивчали в пошуковому відкритому рандомізованому 12-тижневому дослідженні, у якому застосовували нінтеданіб у дозі 150 мг двічі на добу та пірфенідон як додаткову терапію (з титруванням дози до 801 мг три рази на добу) в порівнянні із застосуванням нінтеданібу в дозі 150 мг два рази на добу у вигляді монотерапії у 105 рандомізованих пацієнтів. Первинною кінцевою точкою був відсоток пацієнтів, у яких через 12 тижнів виникли небажані явища з боку шлунково-кишкового тракту, порівняно з вихідним рівнем. Такі явища були частими, що узгоджувалось зі встановленим профілем безпеки кожного компонента. Найчастішими небажаними явищами були діарея, нудота та блювота у пацієнтів, які отримували пірфенідон разом з нінтеданібом, порівняно з тими, хто отримував нінтеданіб як монотерапію. Середні абсолютні зміни ФЖЄЛ (форсованої життєвої ємності легень) через 12 тижнів порівняно з вихідним рівнем становили -?13,3 (17,4) мл у пацієнтів, які отримували нінтеданіб та пірфенідон як додаткову терапію (n = 48), у порівнянні з - 40,9 (31,4) мл у пацієнтів, які отримували нінтеданіб у вигляді монотерапії (n = 44).
Інші хронічні фіброзуючі інтерстиціальні захворювання легень (ІЗЛ) з прогресуючим фенотипом
Клінічну ефективність нінтеданібу вивчали у пацієнтів з іншими хронічними фіброзуючими ІЗЛ з прогресуючим фенотипом в рамках подвійно сліпого рандомізованого плацебо-контрольованого дослідження фази III (INBUILD). Пацієнтів з ІЛФ виключали. Пацієнтів з клінічним діагнозом хронічного фіброзуючого ІЗЛ реєстрували, якщо вони мали відповідний фіброз (характерні ознаки фіброзу більше 10%) за даними КТВРЗ та клінічні ознаки прогресування (зниження ФЖЄЛ на ≥10%, зниження ФЖЄЛ ≥ 5% та < 10% із погіршенням симптомів абоза даними КТВРЗ чи погіршення симптомів та за даними КТВРЗ за 24 місяці до скринінгу). Пацієнти повинні були мати ФЖЄЛ ≥45% від належного та DLco — дифузійна здатність легень за оксидом вуглецю - від 30% до < 80% від належного. У пацієнтів повинно було відзначатись прогресування захворювання, незважаючи на лікування, що розцінювалось дослідниками як відповідне клінічній практиці у зв’язку з відповідним ІЗЛ.
663 пацієнтів було рандомізовано у співвідношенні 1:1 до групи застосування препарату 150 мг 2 рази/добу або відповідної дози плацебо протягом мінімум 52 тижнів. Медіана прийому препарату ОФЕВ протягом усього дослідження становила 17,4 місяця, а в середньому тривалість прийому була 15,6 місяця. Рандомізація була стратифікована на основі КТВРЗ патерну фіброзних змін за даними головних експертів. Було рандомізовано 412 пацієнтів з патерном фіброзних змін, що відповідають звичайній інтерстиціальній пневмонії (ЗІП) за даними КТВРЗ, та 251 пацієнта з іншими патернами фіброзних змін за даними КТВРЗ . Для аналізу в цьому дослідженні було визначено 2 первинні популяції: всі пацієнти (загальна популяція) та пацієнти з патерном фіброзних змін, що відповідає ЗІП за даними КТВРЗ. Пацієнти з іншими патернами фіброзних змін за даними КТВРЗ представляли додаткову популяцію.
Первинною кінцевою точкою був річний показник скорочення форсованої життєвої ємності легенів (ФЖЄЛ) (мл) протягом 52тижнів. Ключовими вторинними кінцевими точками були абсолютна зміна від вихідного рівня за Коротким опитувальником з ознак інтерстиціального захворювання легень Кінга (K-BILD) протягом 52 тижнів, час до першого гострого загострення ІЗЛ або смерті протягом 52 тижнів та час до настання смерті протягом 52 тижнів.
Пацієнти мали середній вік (середнє відхилення [СВ; мін.-макс.]) 65,8 (9,8; 27-87) років і середній ФЖЄЛ 69,0% від належного (15,6; 42-137). Основними клінічними діагнозами ІЗЛ у групах, представлених у дослідженні, був гіперсенситивний пневмоніт (26,1%), аутоімунні ІЗЛ (25,6%), ідіопатична неспецифічна інтерстиціальна пневмонія (18,9%), некласифікована ідіопатична інтерстиціальна пневмонія (17,2%) та інші ІЗЛ (12,2%).
Річний показник зниження ФЖЄЛ
Річний показник зниження ФЖЄЛ (мл) протягом 52 тижнів продемонстрував суттєве зниження у пацієнтів, які отримували ОФЕВ, порівняно з тими, хто отримував плацебо (таблиця 6), що відповідає відносній ефективності лікування 57,0%.
Таблиця 6.
Річний показник зниження ФЖЄЛ (мл) протягом 52 тижнів
|
Параметри |
Плацебо |
ОФЕВ 150мг двічі на добу |
|
Кількість пацієнтів, дані яких були проаналізовані |
331 |
332 |
|
Показник 1 (СВ) зниження протягом 52 тижнів |
-187,8 (14,8) |
-80,8 (15,1) |
|
Порівняння з плацебо |
||
|
Різниця 1 |
|
107,0 |
|
95% ДІ |
|
(65,4; 148,5) |
|
p-значення |
|
<0,0001 |
1 На основі випадкової регресії коефіцієнтів з фіксованим категоричним впливом лікування, КТВРЗ патернів, фіксованого постійного впливу часу, вихідного показника ФЖЄЛ [мл], а також включаючи залежність лікування від часу та вихідного рівня від часу.
Подібні результати спостерігалися у сопервинній популяції пацієнтів з ЗІП-патерном за даними КТВРЗ. Вплив від лікування був послідовним у додатковій популяції пацієнтів з іншими патернами фіброзних змін за даними КТВРЗ (р-значення залежності 0,2268) (рис. 2).
Рис.2. Діаграма щорічного темпу зниження ФЖЄЛ (мл) протягом 52 тижнів серед популяцій пацієнтів
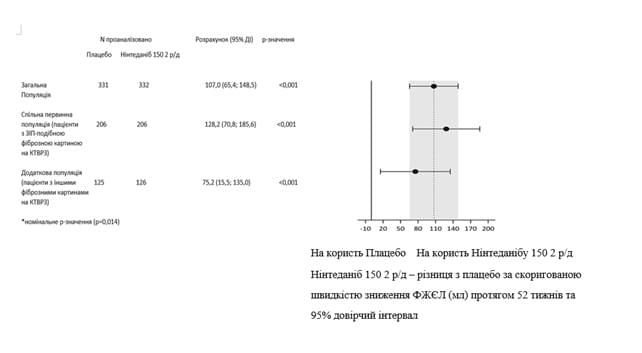
Вплив препарату ОФЕВ на зменшення річного показника зниження ФЖЄЛ був підтверджений усіма попередньо визначеними аналізами чутливості; послідовні результати спостерігались у заздалегідь визначених підгрупах ефективності: за статтю, віком, расовою приналежністю, вихідним рівнем ФЖЄЛ (% від належного) та первинним основним клінічним діагнозом ІЗЛ у групах.
На рис. 3 показано еволюцію зміни ФЖЄЛ від вихідного рівня в групах лікування.
Рис. 3 Середня (СПСВ) виявлена зміна ФЖЄЛ від вихідного рівня (мл) протягом 52 тижнів3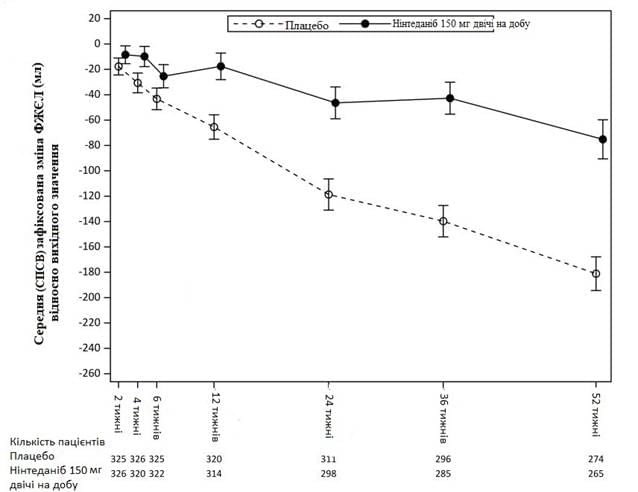
2 р/д - двічі на добу
Крім того, сприятливі ефекти препарату ОФЕВ спостерігалися на скоригованій середній абсолютній зміні ФЖЄЛ (% від належного) в порівнянні з вихідним рівнем на 52 тижні. Скориговане середнє значення абсолютної зміни ФЖЄЛ (% від належного) від базового рівня до 52 тижня було нижчим у групі нінтеданібу (-2,62%), ніж у групі плацебо (-5,86%). Скорегована середня різниця між групами лікування становила 3,24 (95% ДІ: 2,09; 4,40; номінальне р <0,0001).
Аналіз пацієнтів, що досягли терапевтичного ефекту за показником ФЖЄЛ
Частка пацієнтів, які досягли терапевтичного ефекту за показником ФЖЄЛ і яка визначалась як пацієнти з відносним зниженням рівня ФЖЄЛ % від належного, не більше ніж на 5%, була вищою у групі препарату ОФЕВ порівняно з плацебо. Аналогічні результати спостерігалися в аналізах з використанням порогу 10% (табл. 7).
Таблиця 7.
Річний показник зниження ФЖЄЛ (мл) протягом 52 тижнів
|
Лікування |
Плацебо |
ОФЕВ, 150 мг двічі на добу |
|
Кількість пацієнтів, дані яких були проаналізовані
|
331 |
332 |
|
5% граничне значення |
||
|
Кількість (%) пацієнтів, що досягли терапевтичного ефекту за показником ФЖЄЛ1 |
104 (31,4) |
158 (47,6) |
|
У порівнянні з плацебо |
||
|
Співвідношення шансів2 |
|
2,01 |
|
95% ДІ |
|
(1,46; 2,76) |
|
p-величина |
|
<0,0001 |
|
10% граничне значення |
||
|
Кількість (%) пацієнтів, що досягли терапевтичного ефекту за показником ФЖЄЛ1 |
169 (51,1) |
197 (59,3) |
|
У порівнянні з плацебо |
||
|
Співвідношення шансів2 |
|
1,42 |
|
95% ДІ |
|
(1,04; 1,94) |
|
p-величина |
|
0,0268 |
1Пацієнти, що досягли терапевтичного ефекту, який оціновався за показником ФЖЄЛ, це пацієнти, які не мають відносного зниження ФЖЄЛ (% від належного) більше ніж на 5% або більше ніж на 10 % залежно від порогових показників та з оцінкою ФЖЄЛ на 52 тижні (пацієнти з відсутніми даними на 52 тижні вважалися такими, що не досягли терапевтичного ефекту).
2На основі моделі логістичної регресії з безперервним коваріатним базовим рівнем ФЖЄЛ % та бінарним коваріатним КТВРЗ-патерном
Час до першого загострення ІЗЛ або смерті
Протягом усього дослідження частка пацієнтів, що мали хоча б один випадок першого гострого загострення ІЗЛ або смерті, становила 13,9% у групі ОФЕВ та 19,6% у групі плацебо. ВР становив 0,67 (95% ДІ: 0,46, 0,98; номінальне р = 0,0387), що свідчить про зниження на 33% ризику першого загострення ІЗЛ або смерті у пацієнтів, які отримували ОФЕВ порівняно з плацебо (рис. 4).
Рис.4. Час до першого загострення ІЗЛ або смерті
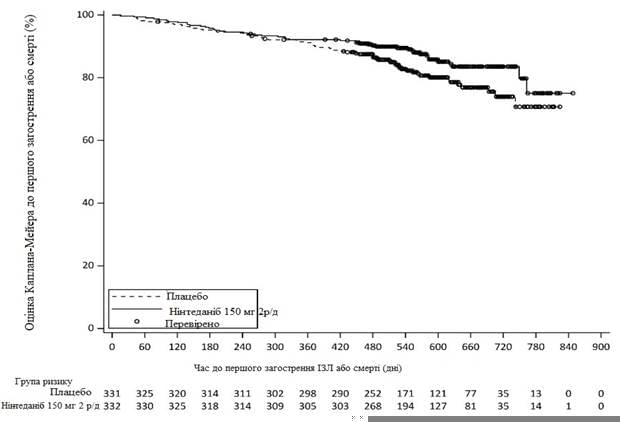
2 р/д - двічі на добу
Аналіз виживаності
Ризик смерті був нижчим у групі препарату ОФЕВ порівняно з групою плацебо. ВР становив 0,78 (95% ДІ: 0,50, 1,21; номінальне р = 0,2594), що свідчить про 22% зниження ризику смерті у пацієнтів, які отримували ОФЕВ, порівняно з плацебо.
Час до прогресування (абсолютне зниження ФЖЄЛ (% від належного) на ≥ 10%) або смерті
У випробуванні INBUILD ризик прогресування (абсолютне зниження ФЖЄЛ (% від належного) на ≥ 10%) або смерті був меншим у пацієнтів, які отримували ОФЕВ. Частка пацієнтів із визначеною подією становила 35,2% у групі препарату ОФЕВ та 48,3% у групі плацебо. ВР становив 0,66 (95% ДІ: 0,53; 0,83; р = 0,0003), що вказує на 34% зниження ризику прогресування (абсолютне зниження ФЖЄЛ (% від належного) на ≥ 10%) або смерті у пацієнтів, які отримували ОФЕВ, порівняно з плацебо.
Якість життя
Скоригована середня зміна від вихідного рівня за загальним балом K-BILD на 52 тижні становила - 0,79 одиниці у групі плацебо та 0,55 у групі препарату ОФЕВ. Різниця між групами лікування становила 1,34 (95% ДІ: - 0,31; 2,98; номінальне р = 0,1115).
Скоригована середня абсолютна зміна від вихідного рівня за показниками симптомів задишки згідно з опитувальником L-PF на 52 тижні становила 4,28 у групі препарату ОФЕВ порівняно з 7,81 у групі плацебо. Скоригована середня різниця між групами на користь препарату ОФЕВ становила -3,53 (95% ДІ: - 6,14; - 0,92; номінальне р = 0,0081). Скоригована середня абсолютна зміна від вихідного рівня за показниками симптомів кашлю згідно з опитувальником L-PF на 52 тижні становила - 1,84 у групі препарату ОФЕВ порівняно з 4,25 у групі плацебо. Скоригована середня різниця між групами на користь препарату ОФЕВ становила - 6,09 (95% ДІ: - 9,65; - 2,53; номінальне р = 0,0008).
Інтерстиціальне захворювання легень при системній склеродермії (системному склерозі) (ІЗЛ-СС).
Клінічна ефективність нінтеданібу вивчалася у пацієнтів з ІЗЛ-СС в рамках подвійного сліпого рандомізованого плацебо-контрольованого дослідження фази III (SENSCIS). У пацієнтів діагностували ІЗЛ-СС на основі класифікаційних критеріїв СС Американського коледжу ревматології/Європейської ліги проти ревматизму 2013 та комп’ютерної томографії високої роздільної здатності (КТВРЗ) грудної клітки протягом попередніх 12 місяців. 580 пацієнтів були рандомізовані у співвідношенні 1:1 та отримували або ОФЕВ 150мг двічі на добу, або плацебо протягом мінімум 52 тижнів. З них лікування пройшли 576 пацієнтів. Рандомізація була стратифікована за допомогою статусу антитопоізомеразних антитіл (ATA). Окремі пацієнти перебували на лікуванні в «сліпому режимі» до 100 тижнів (медіанна експозиції ОФЕВ 15,4 міс.; середня експозиція ОФЕВ 14,5 міс.).
Первинною кінцевою точкою був річний показник скорочення форсованої життєвої ємності легенів (ФЖЄЛ) протягом 52тижнів. Ключовими вторинними кінцевими точками були абсолютна зміна від вихідного рівня з боку шкіри за модифікованою шкалою Роднана (mRSS) на 52 тижні та абсолютна зміна від вихідного рівня загального бала за анкетою лікарні Святого Георгія для оцінки дихальної функції (SGRQ) на 52 тижні.
У загальній популяції 75,2 % пацієнтів були жінками. Середній (стандартне відхилення (СВ, мін.-макс.)) вік становив 54 (12,2; 20 - 79) роки. Всього 51,9 % пацієнтів мали дифузну шкірну форму системного склерозу (СС); 48,1% - обмежену форму шкірного СС. Середній (СВ) час з моменту появи першого «не Рейно» симптому становив 3,49 (1,7) року. 49,0 % пацієнтів отримували стабільну терапію мікофенолатом на вихідному рівні. Профіль безпеки у пацієнтів, що отримували або не отримували мікофенолат на вихідному рівні, був подібним.
Річний показник зниження ФЖЄЛ
Річний показник зниження ФЖЄЛ (мл) протягом 52 тижнів значно зменшився на (41,0) мл у пацієнтів, які отримували ОФЕВ, порівняно з тими, хто отримував плацебо (таблиця 8), що відповідає відносній ефективності лікування 43,8 %.
Таблиця 8.
Річний показник зниження ФЖЄЛ (мл) протягом 52 тижнів
|
Лікування |
Плацебо |
ОФЕВ 150мг двічі на добу |
|
Кількість пацієнтів, дані яких були проаналізовані |
288 |
287 |
|
Показник1 (СП) зниження протягом 52 тижнів |
-93,3 (13,5) |
-52,4 (13,8) |
|
Порівняння з плацебо |
|
|
|
Різниця 1 |
|
41,0 |
|
95% ДІ |
|
(2,9, 79,0) |
|
p-значення |
|
<0,05 |
1 На основі випадкової регресії коефіцієнтів з фіксованим категоричним впливом лікування, статусу ATA, статі, фіксованого постійного впливу часу, вихідного показника ФЖЄЛ (мл), віку, росту, а також включаючи залежність ефективності лікування від часу та залежність змін від вихідного рівня від часу. Випадковий ефект був включений для конкретного моменту реєстрації пацієнта та часу. Внутрішні похибки були змодельовані за неструктурованою дисперсійно-коваріаційною матрицею. Міжособистісна мінливість моделювалась за дисперсійно-коваріаційною матрицею з дисперсійними компонентами.
Вплив ОФЕВ на зменшення річного показника зниження ФЖЄЛ був подібним у попередньо визначених аналізах чутливості; гетерогенність не була виявлена у попередньо визначених підгрупах (наприклад, за віком, статтю та застосуванням мікофенолату).
Крім того, аналогічні ефекти спостерігалися щодо інших кінцевих точок для легеневої функції, зокрема зміни ФЖЄЛ на 52-му тижні (рис. 5 та таблиця 9) від вихідного рівня та прогнозна швидкість зниження ФЖЄЛ у % протягом 52 тижнів (таблиця 10), забезпечуючи тим самим додаткове обґрунтування ефекту ОФЕВ з точки зору уповільнення прогресування ІЗЛ-СС. Крім того, у меншої кількості пацієнтів у групі ОФЕВ відзначалось абсолютне скорочення ФЖЄЛ >5% (20,6% у групі ОФЕВ проти 28,5% у групі плацебо, ВШ=0,65, p=0,0287). Відносне скорочення ФЖЄЛ у мл >10% було подібним у групах (16,7% у групі ОФЕВ проти 18,1% у групі плацебо, ВШ=0,91, p=0,6842). У цих аналізах відсутні значення ФЖЄЛ на 52 тижні були розраховані за найгіршим значенням пацієнта під час лікування.
Дослідницький аналіз даних до 100 тижнів (максимальна тривалість лікування у випробуванні SENSCIS) показує, що вплив лікування препаратом ОФЕВ на уповільнення прогресування ІЗЛ-СС зберігається понад 52 тижні.
Рис. 5: Середня (СПСВ) виявлена зміна ФЖЄЛ від вихідного рівня (мл) протягом 52 тижні
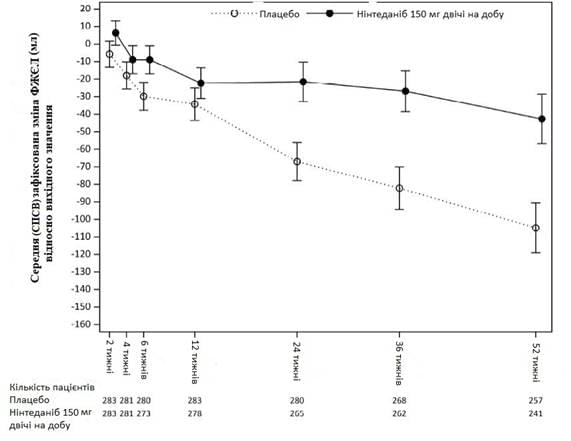
Таблиця 9.
Абсолютна зміна ФЖЄЛ (мл) від вихідного рівня на 52 тижні
|
Лікування |
Плацебо |
ОФЕВ 150мг двічі на добу |
|
Кількість пацієнтів, дані яких були проаналізовані |
288 |
288 |
|
Середнє (СВ) на вихідному рівні |
2541,0 (815,5) |
2458,5 (735,9) |
|
Середня1 (СП) зміна від вихідного рівня на 52 тижні |
-101,0 (13,6) |
-54,6 (13,9) |
|
Порівняння з плацебо |
|
|
|
Середнє 1 |
|
46.4 |
|
95% ДІ |
|
(8,1; 84,7) |
|
p-значення |
|
<0,05 |
1 На основі змішаної моделі повторних вимірів (MMRM) з фіксованим категоричним впливом статусу ATA, візиту, взаємодії лікування за візитом, взаємодії вихідного рівня за візитом, віку, статі та росту. Візит був повторюваним виміром. Внутрішні похибки були змодельовані за неструктурованою дисперсійно-коваріаційною матрицею. Скориговане середнє значення ґрунтувалось на кількості всіх проаналізованих пацієнтів у моделі (не тільки тих, яким вимірювання проводилось на вихідному рівні та на 52 тижні).
Таблиця 10.
Річний показник зниження ФЖЄЛ (%) протягом 52 тижнів
|
Лікування |
Плацебо |
ОФЕВ 150мг двічі на добу |
|
Кількість пацієнтів, дані яких були проаналізовані |
288 |
287 |
|
Показник1 (СП) зниження протягом 52 тижнів |
-2.6 (0,4) |
-1,4 (0,4) |
|
Порівняння з плацебо |
|
|
|
Різниця 1 |
|
1,15 |
|
95% ДІ |
|
(0,09; 2,21) |
|
p-значення |
|
<0,05 |
1 На основі випадкової регресії коефіцієнтів з фіксованим категоричним впливом лікування, статусу ATA, фіксованого постійного впливу часу, вихідного показника ФЖЄЛ (% від належного), а також включаючи залежність ефективності лікування від часу та залежність змін від вихідного рівня від часу. Випадковий ефект був включений для конкретного моменту реєстрації пацієнта та часу. Внутрішні похибки були змодельовані за неструктурованою дисперсійно-коваріаційною матрицею. Міжособистісна мінливість моделювалась за дисперсійно-коваріаційною матрицею з дисперсійними компонентами.
Зміна від вихідного рівня з боку шкіри за модифікованою шкалою Роднана (mRSS) на 52 тижні
Скоригована середня абсолютна зміна від вихідного рівня за mRSS на 52 тижні була подібною у групі ОФЕВ (-2,17 (95 % ДІ -2,69, -1,65)) та групі плацебо (-1,96 (95 % ДІ -2,48, -1,45)). Скоригована середня різниця між групами лікування становила -0,21 (95 % ДІ -0,94, 0,53; p=0,5785).
Зміна від вихідного рівня загального бала за анкетою лікарні Святого Георгія (SGRQ) на 52 тижні
Скоригована середня абсолютна зміна від вихідного рівня загального балу за SGRQ на 52 тижні була подібною у групі ОФЕВ (0,81 (95% ДІ -0,92, 2,55)) та групі плацебо (-0,88 (95 % ДІ -2,58, 0,82)). Скоригована середня різниця між групами лікування становила 1,69 (95 % ДІ -0,73, 4,12; p=0,1711).
Аналіз виживаності
Рівень смертності протягом всього періоду випробування був подібним у групі ОФЕВ (N=10; 3,5 %) та групі плацебо (N=9; 3,1 %). В аналізі часу до смерті протягом всього періоду випробування було визначено значення ВШ 1,16 (95 % ДІ 0,47, 2,84; p=0,7535).
Інтервал QT
В рамках спеціального дослідження за участю пацієнтів з нирковоклітинним раком були зроблені вимірювання інтервалу QT/комплексу QT; в результаті цих вимірювань встановлено, що разова пероральна доза 200 мг нінтеданібу, а також багаторазові пероральні дози 200 мг нінтеданібу із прийомом в режимі двічі на добу протягом 15 днів не подовжувати інтервал QT з коригуванням Фрідеріція.
Діти.
ОФЕВ не досліджували у педіатричній практиці при ІЛФ.
Фармакокінетика
Абсорбція
Максимальна концентрація нінтеданібу в плазмі крові досягається приблизно через 2-4 години після перорального прийому препарату у формі м’яких желатинових капсул під час їди (діапазон 0,5-8 годин). Абсолютна біодоступність дози 100 мг складає у здорових добровольців 4,69% (90% ДІ: 3,615-6,078). Абсорбція та біодоступність зменшуються внаслідок дії транспортера та суттєвого пресистемного метаболізму. Встановлено, що експозиція нінтеданібу збільшується пропорційно дозі (у діапазонах доз 50-450 мг один раз на добу та 150-300 мг двічі на добу). Стійкі концентрації в плазмі крові досягаються, як максимум, впродовж одного тижня після початку прийому.
Експозиція нінтеданібу збільшується після їди приблизно на 20% у порівнянні з прийомом препарату натще (ДІ: 95,3-152,5%), а всмоктування сповільнюється (медіана часу досягнення максимальної концентрації в плазмі крові натще (tmax) - 2,00 години; після їди - 3,98 години).
Розподіл
Розподіл нінтеданібу здійснюється шляхом двофазної кінетики. Після внутрішньовенної інфузії під час термінальної фази спостерігається великий об’єм розподілу (Vss): 1050 л, геометричний коефіцієнт варіації (gCV) 45,0%).
Зв’язування нінтеданібу з білками плазми людиниin vitro вважається значним, пов’язана фракція складає 97,8%. Основним білком, що бере участь в зв’язуванні, вважається альбумін сироватки крові. Нінтеданіб переважно розподіляється в плазмі, співвідношення кров/плазма складає 0,869.
Біотрансформація
Основною реакцією, що бере участь в метаболізмі нінтеданібу, є гідролітичне розщеплювання за допомогою естераз, що призводить до утворення вільного кислого метаболіту нінтеданібу (BIBF 1202). Надалі BIBF 1202 глюкуронізується ферментами уридін-5’-дифосфат-глюкуронозилтрасферази (UGT), а саме UGT 1A1, UGT 1A7, UGT 1A8 та UGT 1A10, з утворенням глюкуроніду BIBF 1202.
Біотрансформація нінтеданібу за участю ізоферментів CYP відбувається лише незначною мірою; основну роль у цьому процесі відіграє ізофермент CYP 3A4. У дослідженні ADME у людини основний метаболіт, що утворюється за участю ізоферментів CYP, виявити в плазмі не вдалося. За даними дослідженняin vitro CYP-залежний метаболізм складає приблизно 5%, тоді як розщеплювання, здійснюване естеразами, складає 25%. Нінтеданіб, BIBF 1202 та глюкуронід BIBF 1202 не пригнічували і не стимулювали ізоферменти CYP і в доклінічних дослідженнях. Тому не слід очікувати лікарських взаємодій між нінтеданібом і субстратами CYP, інгібіторами CYP або індукторами CYP.
Виведення
Загальний кліренс плазми після внутрішньовенної інфузії є високим (1390 мл/хв, gCV - 28,8%). Виведення із сечею незміненої активної речовини впродовж 48 годин після прийому нінтеданібу внутрішньо складає приблизно 0,05% від величини дози (gCV - 31,5%), а після внутрішньовенного введення - приблизно 1,4% (gCV - 24,2%); нирковий кліренс складає 20 мл/хв (gCV - 32,6%). Після прийому внутрішньо [14C]-нінтеданібу радіоактивний матеріал виводився переважно з жовчю і виявлявся в калі (93,4% дози, gCV - 2,61%). Частка ниркової екскреції в загальному кліренсі є низькою (0,649% дози (gCV - 26,3%)). Виведення вважається повним (більше 90%) через 4 дні після прийому. Період напіввиведення нінтеданібу в термінальній стадії складає від 10 до 15 годин (gCV приблизно 50%).
Лінійність/нелінійність
Можна припустити, що фармакокінетика (ФК) нінтеданібу лінійна відносно часу (тобто дані щодо застосування разової дози можуть бути екстрапольовані на дані щодо багаторазового використання). Значення Cmax в результаті накопичення препарату після багаторазового застосування перевищує показник Cmax разової дози в 1,04 раза, а значення AUCτ - в 1,38 раза. Мінімальні остаточні концентрації нінтеданібу залишаються стабільними протягом більше одного року.
Транспортування
Нінтеданіб є субстратом для глікопротеїну P (P-gp). Див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій» для отримання інформації стосовно можливої взаємодії нінтеданібу із цим транспортером. Показано, що нінтеданібin vitro не є субстратом або інгібітором OATP-1B1, OATP-1B3, OATP-2B1, OCT-2 або MRP-2. Нінтеданіб також не є субстратом BCRP.In vitro було встановлено, що нінтеданіб має слабку інгібувальну активність відносно OCT-1, BCRP і P-gp, що, як вважається, має невелику клінічну значущість. Такий же висновок зроблений стосовно нінтеданібу як субстрату OCT-1.
Фармакокінетика у особливих груп пацієнтів
Фармакокінетичні властивості нінтеданібу були порівнянні у здорових добровольців, пацієнтів з ІЛФ, пацієнтів з іншими інтерстиціальними захворюваннями легень з прогресуючим фенотипом, пацієнтів з ІЗЛ-СС та онкологічними захворюваннями. З огляду на результати популяційного фармакокінетичного аналізу у пацієнтів з ІЛФ та недрібноклітинним раком легенів (НДРЛ) (N=1191) і описових досліджень, на дію нінтеданібу не впливали такі чинники, як стать (з поправкою на масу тіла), порушення функції нирок легкого і середнього ступеня тяжкості (розраховане на основі кліренсу креатиніну), вживання алкоголю або генотип Р-глікопротеїну. Популяційний фармакокінетичний аналіз виявив помірний вплив статі, маси тіла і расової приналежності на дію нінтеданібу, як описано нижче. У зв’язку з тим, що спостерігалася висока міжсуб’єктна варіабельність експозиції, ці несуттєві впливи не вважалися клінічно значущими (див. розділ «Особливості застосування»).
Вік
Експозиція нінтеданібу лінійно збільшується з віком. У 45-річних пацієнтів значення AUCτ,ss було нижче на 16%, а у 76-річних пацієнтів вище на 13% в порівнянні з пацієнтами, медіана віку яких складала 62 роки. Діапазон віку, що оцінювався в ході аналізу, складав 29-85 років; вік більше 75 років відзначався приблизно у 5% популяції пацієнтів. На основі моделі популяційного фармакокінетичного аналізу встановлено, що у пацієнтів віком від 75 років спостерігалося збільшення експозиції нінтеданібу приблизно на 20-25%, порівняно із пацієнтами віком до 65 років.
Аналогічні дослідження у дітей не проводилися.
Маса тіла
Спостерігається зворотна кореляція між масою тіла і експозицією нінтеданібу. У пацієнтів з масою тіла 50 кг (5-й процентиль) величина AUCτ,ss збільшувалася на 25%, а у пацієнтів з масою тіла 100 кг (95-й процентиль) зменшувалася на 19% у порівнянні з пацієнтами, медіана маси тіла яких складала 71,5 кг.
Раса
Середня експозиція нінтеданібу вища на 33-50 % у пацієнтів китайців, тайванців та індусів і на 16 % вища у японців, а у корейців - на 16-22 % нижча, ніж у пацієнтів європеоїдної раси (з поправкою на масу тіла). Дані стосовно пацієнтів негроїдної раси є дуже обмеженими; діапазон цих даних схожий на такий у пацієнтів європеоїдної раси.
Порушення функції печінки
У спеціалізованій фазі І дослідження у добровольців з легкими порушеннями функції печінки (клас А за шкалою Чайлда - П’ю) експозиція на основі Cmax та AUC була в 2,2 раза вищою порівняно з такою у здорових добровольців (90% ДІ 1,3-3,7 для Cmax та 90% ДІ 1,2-3,8 для AUC відповідно). У добровольців з помірними порушеннями функції печінки (клас B за шкалою Чайлда-П’ю) порівняно зі здоровими добровольцями експозиція була в 7,6 раза вищою на основі Cmax (90% ДІ 4,4-13,2) та в 8,7 раза вищою на основі AUC (90% ДІ 5,7-13,1) відповідно. Дослідження у пацієнтів з тяжкими порушеннями функції печінки (клас C за шкалою Чайлда - П’ю) не проводилось.
Одночасна терапія з пірфенідоном
У спеціальному фармакокінетичному дослідженні вивчали супутнє застосування нінтеданібу та пірфенідону пацієнтам з ІЛФ (ідіопатичним легеневим фіброзом). Група 1 отримала однократну дозу 150 мг нінтеданібу до та після збільшення дози пірфенідону до 801 мг тричі на добу у рівноважному стані (N = 20 пролікованих пацієнтів). Група 2 отримала лікування у рівноважному стані із використанням 801 мг пірфенідону тричі на добу й взяла участь у визначенні параметрів ФК до та після 7 днів супутнього лікування разом з нінтеданібом в дозі 150 мг двічі на добу (N = 17 пролікованих пацієнтів). В групі 1 значення скоригованого відношення геометричних середніх [90% довірчий інтервал (ДІ)] Cmax і AUC0-tz нінтеданібу дорівнювали 93 % (57-151 %) та 96 % (70-131 %) відповідно (n = 12 для внутрішньосуб’єктного порівняння). В групі 2 значення скоригованого відношення геометричних середніх (90 % ДІ)) дорівнювали 97 % (86--110%) та 95 % (86-106%) для Cmax,ss і AUCτ,ss пірфенідону відповідно (n = 12 для міжсуб’єктного порівняння).
Це дослідження не виявило жодних доказів значущої фармакокінетичної лікарської взаємодії між нінтеданібом та пірфенідоном при застосуванні в комбінації (див. розділ «Особливості застосування»).
Одночасне лікування з бозентаном
У спеціальному дослідженні фармакокінетики супутнє застосування лікарського засобу ОФЕВ з бозентаном досліджували за участю здорових добровольців. Пацієнти отримували одну дозу ОФЕВ 150 мг до та після кількох доз бозентану 125 мг двічі на добу в умовах стаціонару. Скориговані середні геометричні співвідношення (90% довірчий інтервал (ДІ)) становили 103 % (86 - 124%) та 99 % (91- 107%) для Cmax та AUC0-tz нінтеданібу відповідно (n=13), що вказує на те, що супутнє застосування нінтеданібу з бозентаном не змінює фармакокінетику нінтеданібу.
Коефіцієнт експозиція-відповідь
Аналізи коефіцієнта експозиція-відповідь у пацієнтів із ІЛФ та іншими хронічними фіброзуючими ІЗЛ з прогресуючим фенотипом виявили слабкий зв’язок між рівнем нінтеданібу в плазмі та підвищенням рівня АЛТ та/або АСТ. Фактична введена доза може бути кращим предиктором ризику розвитку діареї будь-якої інтенсивності, навіть якщо не можна виключити рівень нінтеданібу в плазмі як фактор, що визначає ризик (див. розділ «Особливості застосування»).
Показання
ОФЕВ показаний для лікування ідіопатичного легеневого фіброзу (ІЛФ) у дорослих.
Протипоказання
Підвищена чутливість до нінтеданібу, арахісу чи сої або до будь-якої із допоміжних речовин препарату.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
P-глікопротеїн (P-gp)
Нінтеданіб є субстратом P-gp (див. розділ «Фармакологічні властивості. Фармакокінетика»). У спеціальному дослідженні взаємодії препаратів встановлено, що спільне застосування з активним інгібітором P-gp кетоконазолом збільшує експозицію нінтеданібу, судячи з величини AUC, в 1,61 разу, а за показником Cmax в 1,83 раза. Спеціальне дослідження взаємодії препаратів продемонструвало, що одночасне застосування рифампіцину (активного індуктора P-gp) призводить до зменшення експозиції нінтеданібу, за показником AUC на 50,3%, а за показником Cmax на 60,3% (в порівнянні із застосуванням одного нінтеданібу). Активні інгібітори P-gp (наприклад кетоконазол, еритроміцин або циклоспорин) у разі спільного застосування з препаратом ОФЕВ можуть збільшувати експозицію нінтеданібу. У таких пацієнтів переносимість нінтеданібу потрібно ретельно відслідковувати. При виникненні побічних реакцій може бути потрібне призупинення терапії, зниження дози або відміна лікування препаратом ОФЕВ (див. розділ «Спосіб застосування та дози»).
Активні індуктори P-gp (наприклад рифампіцин, карбамазепін, фенітоїн і препарати звіробою звичайного) можуть зменшувати експозицію нінтеданібу. Рекомендується підбір альтернативної супутньої терапії з відсутністю або мінімальною індукуючою дією на систему P-gp.
Ізофермент цитохрому (CYP)
Ізоферменти CYP беруть лише незначну участь у біотрансформації нінтеданібу. У доклінічних дослідженнях нінтеданіб та його метаболіти (BIBF 1202 – вільний кислий метаболіт нінтеданібу і його глюкуронід BIBF 1202) не інгібували і не індукували ізоферменти CYP (див. розділ «Фармакологічні властивості. Фармакокінетика»). Тому вірогідність лікарських взаємодій з нінтеданібом, що ґрунтуються на метаболізмі CYP, вважається невеликою.
Одночасне застосування з іншими препаратами
Можливість взаємодій нінтеданібу з гормональними контрацептивними засобами не вивчалася.
Особливості застосування
Порушення з боку шлунково-кишкового тракту
Діарея
У дослідженнях INPULSIS (див. розділ «Фармакологічні властивості. Фармакодинаміка») діарея була найбільш частим побічним явищем з боку шлунково-кишкового тракту і відзначалася у 62,4% пацієнтів, які отримували препарат ОФЕВ, в порівнянні з 18,4% пацієнтів, які отримували плацебо (див. розділ «Побічні реакції»). У більшості пацієнтів ці небажані явища були легкого і помірного ступеня тяжкості і відзначалися упродовж перших 3 місяців лікування. Діарея стала причиною зниження дози нінтеданібу у 10,7% пацієнтів та припинення терапії нінтеданібом у 4,4% пацієнтів у клінічних дослідженнях.
Протягом післяреєстраційного періоду застосування повідомляли про серйозні випадки діареї, що призводить до зневоднення та електролітних порушень. Лікування діареї (адекватна гідратація та антидіарейні лікарські засоби, наприклад, лоперамід) слід проводити при появі перших ознак. У разі розвитку діареї може бути потрібне переривання лікування. Лікування препаратом ОФЕВ можна відновити у зниженій дозі (100 мг двічі на добу) або повній дозі (150 мг двічі на добу). У разі продовження тяжкої діареї, незважаючи на симптоматичне лікування, терапію препаратом ОФЕВ слід відмінити.
Нудота та блювання
Нудота і блювання були небажаними явищами з боку шлунково-кишкового тракту, про які часто повідомлялося (див. розділ «Побічні реакції»). У більшості пацієнтів відзначалася нудота та блювання легкого або помірного ступеня тяжкості. Нудота стала причиною припинення лікування нінтеданібом у 2,0% пацієнтів. Блювання стало причиною припинення лікування у 0,8% пацієнтів.
Якщо симптоми не зникають, незважаючи на належну симптоматичну терапію (включаючи застосування протиблювотних засобів), може бути потрібне зменшення дози препарату або призупинка лікування. Лікування можна відновити у зниженій дозі (100 мг двічі на добу) або повній дозі (150 мг двічі на добу). Якщо тяжкі симптоми не зникають, терапію препаратом ОФЕВ слід відмінити.
Порушення функції печінки
У пацієнтів з порушеннями функції печінки помірного (клас B за шкалою Чайлда-П’ю) і тяжкого (клас C за шкалою Чайлда-П’ю) ступеня безпечність та ефективність препарату ОФЕВ не вивчалися. Тому лікування таких пацієнтів препаратом ОФЕВ не рекомендується (див. розділи «Спосіб застосування та дози»). З огляду на посилену дію лікарського засобу ризик небажаних реакцій може збільшуватися у пацієнтів із порушеннями функції печінки легкого ступеню (клас А за шкалою Чайлда-П’ю). Для пацієнтів із порушеннями функції печінки легкого ступеню (клас А за шкалою Чайлда-П’ю) необхідно призначати лікування зменшеною дозою ОФЕВ (див. розділи «Спосіб застосування та дози» та «Фармакологічні властивості. Фармакокінетика»)
Застосування нінтеданібу було пов’язане із підвищенням рівня печінкових ферментів (АЛТ, АСТ, лужної фосфатази (ЛФ), гамма-глутамілтрансферази (ГГТ)). Підвищення рівня трансаміназ було загалом оборотним, цей показник повертався до початкових значень після зменшення дози або відміни препарату. Застосування нінтеданібу також було пов’язане із підвищенням рівня білірубіну та ураженням печінки, спричиненим препаратом. Рекомендується оцінювати активність печінкових трансаміназ і концентрацію білірубіну до початку терапії препаратом ОФЕВ, а потім періодично під час лікування (наприклад при кожному візиті пацієнта) або за клінічними показаннями.
Пацієнти з малою масою тіла (< 65 кг), пацієнти азійського походження та жінки мають більший ризик підвищення рівня печінкових ферментів.
Експозиція нінтеданібу з віком пацієнта зростає лінійно, що також може призвести до збільшення ризику підвищення рівня печінкових ферментів (див. розділ «Фармакологічні властивості. Фармакокінетика»). Пацієнтам з цими факторами ризику рекомендований клінічний моніторинг.
У разі підвищення рівня трансаміназ (АСТ або АЛТ) більш ніж в 3 рази вище за верхню межу норми рекомендовано зменшити дозу або перервати терапію препаратом ОФЕВ і проводити пильне спостереження за пацієнтом. Як тільки показники трансаміназ повернуться до початкового рівня, лікування препаратом ОФЕВ можна відновити в повній дозі (150 мг двічі на добу) або в зниженій дозі (100 мг двічі на добу), яка згодом може бути підвищена до повної дози (див розділ «Спосіб застосування та дози»). Якщо підвищення будь-яких показників функції печінки пов’язане з клінічними симптомами ураження печінки, наприклад, жовтяницею, лікування препаратом ОФЕВ слід остаточно припинити. Потрібно досліджувати альтернативні причини підвищення рівнів печінкових ферментів.
Кровотечі
Пригнічення рецептора судинного ендотеліального фактора росту (VEGFR) може бути пов’язано із підвищеним ризиком кровотечі. У дослідженнях INPULSIS лікарського засобу ОФЕВ відсоток пацієнтів, у яких були відзначені небажані явища у вигляді кровотеч, був дещо вищим у групі прийому ОФЕВ (10,3%), ніж у групі плацебо (7,8%). Легкі носові кровотечі були найбільш частим небажаним явищем серед випадків кровотечі. Випадки серйозних кровотеч відзначалися рідко і з практично однаковою частотою у двох групах лікування (плацебо: 1,4%; ОФЕВ: 1,3%).
У дослідження INPULSIS не включали пацієнтів з відомим ризиком розвитку кровотеч, у т.ч. пацієнтів зі спадковою схильністю до кровотеч або пацієнтів, які одержували антикоагулянтну терапію у високих дозах. Протягом післяреєстраційного періоду повідомляли про легкі та тяжкі кровотечі, декотрі з яких були летальними (включаючи пацієнтів, які одержували антикоагулянтну терапію або інші лікарські засоби, що могли спричинити кровотечу, так і пацієнтів без антикоагулянтної терапії). Отже, цій категорії пацієнтів лікування препаратом ОФЕВ можна призначати тільки тоді, коли потенційна користь терапії перевищує потенційний ризик.
Випадки кровотеч протягом післяреєстраційного періоду пов`язані з кровотечами з боку органів травної, дихальної і центральної нервової систем, але не обмежуються лише ними. Найбільша частота кровотеч пов’язана із травною системою.
Артеріальна тромбоемболія
З клінічних досліджень INPULSIS виключали пацієнтів з інфарктом міокарда або інсультом в найближчому анамнезі. Випадки розвитку артеріальної тромбоемболії зустрічалися рідко: у 0,7% пацієнтів, що отримували плацебо, і 2,5% пацієнтів в групі, що отримувала нінтеданіб. Тоді як небажані реакції, що відображають ішемічні захворювання серця, були порівнянні в групах нінтеданібу і плацебо, пацієнтів, у яких розвинувся інфаркт міокарда, виявилося більше в групі нінтеданібу (1,6%) у порівнянні з групою плацебо (0,5%). Необхідно дотримуватися обережності при лікуванні пацієнтів з високим серцево-судинним ризиком, включаючи відоме захворювання коронарних артерій. Слід розглянути можливість перерви в лікуванні пацієнтів, у яких розвинулися симптоми гострої міокардіальної ішемії.
Венозна тромбоемболія
У дослідженнях INPULSIS не спостерігалося підвищеного ризику розвитку венозних тромбоемболічних ускладнень у пацієнтів, які приймали нінтеданіб. Проте у зв’язку з особливостями механізму дії нінтеданібу у пацієнтів можливе відзначатися підвищення ризику розвитку тромбоемболічних явищ.
Перфорації шлунково-кишкового тракту (ШКТ)
У дослідженнях INPULSIS кількість пацієнтів з перфорацією була дуже низькою в обох групах лікування: 0% у групі плацебо, 0,3% у групі прийому лікарського засобу ОФЕВ (спостерігалася у двох пацієнтів). Проте у зв’язку з особливостями механізму дії нінтеданібу у пацієнтів може підвищуватися ризик розвитку перфорацій ШКТ. Протягом післяреєстраційного періоду повідомляли про випадки перфорації шлунково-кишкового тракту, декотрі з яких були летальними. Особливу увагу слід приділяти лікуванню пацієнтів, яким раніше проводили абдомінальні хірургічні втручання, які мають пептичну виразку і дивертикулярну хворобу в анамнезі або у разі супутнього застосування кортикостероїдів або НПЗП. У зв’язку з цим ОФЕВ можна застосовувати лише як мінімум через 4 тижні після абдомінальних хірургічних втручань. У разі виникнення перфорації ШКТ терапію препаратом ОФЕВ потрібно припиняти.
Артеріальна гіпертензія
Прийом препарату ОФЕВ може підвищувати артеріальний тиск, тому слід періодично та за клінічними показниками вимірювати артеріальний тиск.
Порушення загоєння ран
У дослідженнях INPULSIS збільшення частоти порушень загоєння ран не спостерігалося. З огляду на механізм дії нінтеданібу, ця речовина може негативно впливати на загоєння ран. Спеціальних досліджень, в яких вивчався б вплив нінтеданібу на загоєння ран, не проводилося. Тому лікування препаратом ОФЕВ має починатися або поновлюватися (якщо здійснювалася перерва у зв’язку з хірургічним втручанням) з урахуванням клінічної думки про адекватність загоєння рани.
Одночасна терапія з пірфенідоном
Одночасне призначення нінтеданібу з пірфенідоном було вивчене у дослідженні з паралельними групами японських пацієнтів з ІЛФ. 24 пацієнти отримували 150 мг нінтеданібу двічі на добу (13 пацієнтів отримували нінтеданіб одночасно зі стандартними дозами пірфенідону в рамках тривалого лікування; 11 пацієнтів отримували лише нінтеданіб). У зв’язку з коротким періодом одночасної дії і малою кількістю пацієнтів, жодні висновки про переваги/ризики комбінованого лікування із пірфенідоном не можуть бути зроблені.
Вплив на інтервал QT
Жодних ознак подовження інтервалу QT при застосуванні нінтеданібу в рамках програми клінічних досліджень не виявлено (див. розділ «Фармакологічні властивості. Фармакодинаміка»). Оскільки відомо, що деякі інші інгібітори тирозинкінази впливають на QT, слід з обережністю призначати нінтеданіб пацієнтам, які знаходяться в групі ризику подовження інтервалу QT.
Алергічні реакції
Відомо, що продукти лікувального харчування з вмістом сої спричиняють алергічні реакції, у тому числі тяжкий анафілактичний шок, в осіб із алергією на сою. Пацієнти з відомою алергією на арахісовий білок знаходяться в групі ризику розвитку тяжких реакцій на препарати із вмістом сої. 1 капсула по 100 мг містить лецитину соєвого 1,2 мг; 1 капсула по 150 мг містить лецитину соєвого – 1,8 мг.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
ОФЕВ має незначний вплив на здатність керувати транспортним засобом або іншими механізмами. Під час застосування препарату ОФЕВ пацієнтам потрібно рекомендувати дотримуватися обережності при управлінні транспортними засобами або іншими механізмами.
Спосіб застосування та дози
Лікування препаратом ОФЕВ слід розпочинати та проводити під наглядом лікаря, який має досвід діагностики та лікування ІЛФ.
Дози
Рекомендована доза препарату становить 150 мг двічі на добу, приблизно через кожні 12 годин. Доза 100 мг двічі на добу рекомендується лише тим пацієнтам, які погано переносять дозу 150 мг двічі на добу.
Якщо будь-яка доза препарату була пропущена, то слід продовжити прийом препарату в початково рекомендованій дозі за розкладом наступного прийому препарату. Якщо доза була пропущена, пацієнт не повинен приймати додаткову дозу препарату. Максимальна добова доза складає 300 мг.
Коригування дози
При розвитку небажаних реакцій на препарат ОФЕВ (див. розділи «Особливості застосування», «Побічні реакції») на додаток до симптоматичної терапії у разі необхідності рекомендується зниження дози або тимчасове переривання лікування доти, доки небажана реакція не знизиться до рівня, дасть змогу відновити терапію. Лікування препаратом ОФЕВ може бути відновлене в повній дозі (150 мг двічі на добу) або в зниженій дозі (100 мг двічі на добу). Якщо пацієнт не переносить дозу препарату 100 мг двічі на добу, лікування препаратом ОФЕВ слід припинити.
У разі підвищення рівня аспартат-амінотрансферази (АСТ) або аланінамінотрансферази (АЛТ) більш ніж в 3 рази вище за верхню межу норми рекомендовано перервати терапію препаратом ОФЕВ. Як тільки показники повернуться до нормального значення, лікування препаратом ОФЕВ можна відновити в зниженій дозі (100 мг двічі на добу), яка згодом може бути збільшена до повної дози (150 мг двічі на добу) (див. розділи «Особливості застосування», «Побічні реакції»).
Особливі групи пацієнтів
Пацієнти літнього віку (? 65 років)
Не відзначено жодних загальних відмінностей з точки зору безпеки та ефективності застосування препарату літнім пацієнтам. Коригування дози препарату залежно від віку пацієнта не потрібне. Пацієнтам віком від 75 років може бути потрібне зниження дози для мінімізації небажаних явищ (див. розділ «Фармакологічні властивості. Фармакокінетика»).
Порушення функції нирок
Нирками виводиться менше 1% разової дози нінтеданібу (див. розділ «Фармакологічні властивості. Фармакокінетика»). Пацієнтам з порушеннями функції нирок легкого або помірного ступеня тяжкості коригувати початкову дозу не потрібно. Для пацієнтів з тяжкими порушеннями функції нирок (кліренс креатиніну < 30 мл/хв.) безпека, ефективність та фармакокінетика нінтеданібу не вивчалися.
Порушення функції печінки
Нінтеданіб виводиться переважно з жовчю/калом (> 90%). Дія посилюється у пацієнтів із порушенням функції печінки (клас А та клас В за шкалою Чайлда–П’ю; див. розділ «Фармакологічні властивості. Фармакокінетика»). У пацієнтів з порушеннями функції печінки легкого ступеня тяжкості (клас А за шкалою Чайлда–П’ю) рекомендована доза ОФЕВ становить 100 мг двічі на день приблизно із 12 годинним інтервалом. Для пацієнтів із легким ступенем тяжкості порушення функції печінки (клас А за шкалою Чайлда–П’ю) необхідно передбачити переривання або припинення лікування для контролю за небажаними реакціями. У пацієнтів з порушеннями функції печінки класів B і C за шкалою Чайлда–П’ю безпека та ефективність нінтеданібу не вивчалися. Тому лікування пацієнтів з порушеннями функції печінки помірного (клас B за шкалою Чайлда–П’ю) і тяжкого (клас C за шкалою Чайлда–П’ю) ступеня препаратом ОФЕВ не рекомендується (див. розділ «Фармакологічні властивості. Фармакокінетика»).
Дитячий вік
Безпечність та ефективність застосування препарату ОФЕВ дітям (віком до 18 років) не вивчалися. Дані відсутні.
Спосіб застосування
ОФЕВ призначений для перорального застосування. Капсули слід приймати з їжею, ковтати цілими, запиваючи водою; їх не потрібно розжовувати чи подрібнювати.
Діти
Препарат не застосовують у педіатричній практиці.
Побічні реакції
Короткий опис профілю безпеки
Нінтеданіб вивчався у клінічних дослідженнях за участю 1 529 пацієнтів з ІЛФ. Представлені дані з безпеки ґрунтуються на двох рандомізованих подвійних сліпих плацебо-контрольованих дослідженнях фази III за участю 1 061 пацієнта, у ході яких порівнювалося лікування нінтеданібом в дозі 150 мг двічі на добу та плацебо упродовж 52 тижнів (INPULSIS-1 та INPULSIS-2).
Найчастішими ПР, пов’язаними із застосуванням нінтеданібу, були діарея, нудота і блювання, біль в ділянці живота, зниження апетиту, зниження маси тіла і підвищення рівня ферментів печінки.
Для одержання інформації стосовно лікування деяких небажаних явищ див. також розділ «Особливості застосування».
Перелік побічних реакцій (ПР)
У таблиці 6 надані побічні реакції відповідно до класів систем органів за MedDRA та за частотою виникнення.
В таблиці 6 підсумована частота побічних реакцій, про які повідомлялося у групі пацієнтів (638), що приймали нінтеданіб в рамках двох плацебо-контрольованих клінічних досліджень фази III тривалістю 52 тижні або у постмаркетингових дослідженнях.
Класифікація частоти виникнення побічних реакцій: дуже часті (>1/10); часті (>1/100 до <1/10); нечасті (>1/1 000 до <1/100); поодинокі (> 1/10 000 до < 1/1 000); рідкісні (< 1/10 000), невідомо (неможливо встановити за наявними даними). У межах кожної групи за частотою небажані реакції представлено в порядку зменшення їх серйозності.
Таблиця 6.
Резюме побічних реакцій на лікарський засіб за категоріями частоти
|
Системно-органний клас
|
Дуже часті (≥ 1/10)
|
Часті
(≥ 1/100 − < 1/10)
|
Нечасті
(≥ 1/1000 − < 1/100)
|
|
З боку кровоносної та лімфатичної системи
|
|
|
Тромбоцитопе-нія
|
|
Метаболічні порушення і порушення харчування
|
Зниження маси тіла, зниження апетиту
|
Дегідратація
|
|
|
З боку судин
|
Кровотечі (див. розділ «Особливості застосування»)
|
Гіпертензія
|
|
|
З боку травної системи
|
Діарея, нудота, біль в ділянці живота
|
Блювота
|
Панкреатит
|
|
З боку печінки та жовчовивідних шляхів
|
Підвищення рівня ферментів печінки
|
Підвищення рівня аланін-амінотрансферази (АЛТ), підвищення рівня аспартат-амінотрансферази (АСТ), підвищення рівня гамма-глутамілтрансферази (ГГТ)
|
Ураження печінки, спричинене препаратом,
гіпербілірубі-немія, підвищення рівня лужної фосфатази крові
|
Опис окремих побічних реакцій
Діарея
Діарея відзначалася у 62,4% пацієнтів, які отримували нінтеданіб. У 3,3% пацієнтів, що приймали нінтеданіб, була зафіксована тяжка діарея. У більше ніж двох третин пацієнтів діарея відзначалася упродовж перших 3 місяців лікування. Діарея стала причиною остаточного припинення терапії у 4,4% пацієнтів; в інших хворих це небажане явище вдалося подолати шляхом застосування протидіарейної терапії, зменшення дози або призупинення лікування (див. розділ «Особливості застосування»).
Підвищення рівнів ферментів печінки
Підвищення рівнів ферментів печінки (див. розділ «Особливості застосування») було зафіксовано у 13,6% пацієнтів, які одержували терапію нінтеданібом. Підвищення рівнів ферментів печінки було оборотним і не пов’язаним із клінічно вираженим захворюванням печінки. Додаткова інформація стосовно особливих категорій пацієнтів, рекомендованих заходів та коригування доз у разі діареї та підвищення рівнів ферментів печінки наведена у розділах «Особливості застосування» та «Спосіб застосування та дози».
Повідомлення про побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського препарату є важливими. Це дає змогу постійно вести моніторинг співвідношення користь/ризик лікарського засобу. Просимо медичних працівників повідомляти про будь-які можливі побічні реакції за допомогою національної системи звітності.
Передозування
Симптоми
Зафіксовані випадки передозування у двох пацієнтів, які брали участь в онкологічній програмі, при застосуванні препарату в максимальній дозі 600 мг впродовж восьми днів. Небажані явища, що спостерігалися, були порівнянні з відомим профілем безпеки нінтеданібу: збільшення активності ферментів печінки і порушення з боку ШКТ. Обидва пацієнти повністю відновилися після небажаних явищ. У дослідженнях INPULSIS був зафіксований один випадок ненавмисного підвищення дози пацієнтом до 600 мг на добу упродовж 21 дня. За період неправильного прийому препарату було зафіксовано розвиток небажаного явища (назофарингіт) легкого ступеня, яке пройшло в цьому періоді без фіксування будь-яких інших небажаних реакцій.
Лікування
Специфічного антидоту немає. У разі передозування необхідно відмінити препарат і проводити симптоматичну терапію.
Застосування у період вагітності або годування груддю
Жінки репродуктивного віку
Нінтеданіб може чинити негативний вплив на плід людини. Жінкам репродуктивного віку під час лікування препаратом ОФЕВ слід вживати запобіжних заходів для уникнення вагітності. Їм потрібно порадити використовувати надійні методи контрацепції під час застосування препарату і протягом щонайменше 3 місяців після прийому останньої дози препарату ОФЕВ. Оскільки дія нінтеданібу на метаболізм та ефективність гормональних контрацептивів не вивчалася, методом вибору запобігання вагітності повинен стати бар’єрний метод.
Вагітність
Спеціальних досліджень щодо застосування препарату ОФЕВ під час вагітності у людини не проводилося, проте в доклінічних дослідженнях у тварин встановлена репродуктивна токсичність цієї активної речовини. Оскільки нінтеданіб може мати ембріотоксичну дію у людини, його не слід застосовувати під час вагітності.
Пацієнткам слід негайно повідомити лікаря про розвиток вагітності під час терапії препаратом ОФЕВ.
Якщо під час терапії препаратом ОФЕВ розвивається вагітність, пацієнтку необхідно проінформувати про потенційну небезпеку ембріотоксичної дії препарату. Також слід розглянути питання про припинення лікування препаратом ОФЕВ.
Годування груддю
Відсутні дані про виділення нінтеданібу і його метаболітів в грудне молоко людини. У доклінічних дослідженнях показано, що у тварин в період лактації в грудне молоко проникає невелика кількість нінтеданібу та його метаболітів (≤ 0,5% від величини дози, що застосовувалася). Тому не можна виключити ризик для новонароджених і грудних дітей. Під час лікування препаратом ОФЕВ годування груддю слід припинити.
Фертильність
У доклінічних дослідженнях ознак порушень фертильності у самців виявлено не було. У дослідженнях підгострої та хронічної токсичності, під час яких рівень системної дії препарату був порівнянний з рівнем, що досягається при використанні максимальної рекомендованої дози у людини (150 мг двічі на добу), ознак порушень фертильності у самок тварин виявлено не було.
Умови зберігання
Термін придатності
3 роки.
Умови зберігання
Зберігати при температурі не вище 25°C, в оригінальній упаковці для захисту від вологи.
Зберігати у недоступному для дітей місці.
Упаковка
По 10 капсул в блістері з алюмінієвої фольги з перфорацією, по 6 блістерів в картонній упаковці.
Категорія відпуску
За рецептом.
Реєстраційні данні
Інструкція для: Офев капсули м`як. по 150 мг №60 (10х6)
Виробник: Берінгер Інгельхайм Інтернешнл ГмбХ, Німеччина
Фарм. група: Антинеопластичні засоби. Інгібітори протеїнкінази.
Реєстрація: № UA/16115/01/02 від 04.07.2017. Наказ № 760 від 04.07.2017
МНН: Nintedanib
Код АТХ:
(L) Протипухлинні лікарські засоби та імуномодулятори
(L01) Протипухлинні препарати
(L01X) Інші протипухлинні препарати
(L01XE) Інгібітор кінази білка (протеінкінази)
(L01XE31) Нінтеданіб





Відгук про Офев капсули м`як. по 150 мг №60 (10х6)
Цей товар ще не має відгуків