Загальна інформація
Сайт Моя Аптека є сучасною інформаційно-довідниковою платформою, яка допомагає знайти і порівняти ціни на будь-які товари аптечного асортименту в аптеках України. Це найпростіший спосіб підібрати ліки за найнижчою ціною в найближчій до Вас аптеці і заощадити до 20-30% на деяких покупках.
Переглядайте актуальні ціни та наявність необхідного товару в будь-якій аптеці на карті в онлайн форматі, бронюйте його всього в кілька кроків і забирайте в зручний час у зазначеній аптеці.
-
Як забронювати ліки на сайті Моя Аптека?
Оформити резерв на необхідний товар можна за допомогою зеленої кнопки із позначкою кошика «Забронювати» на сторінці товару, на карті або прямо з каталогу.
-
Чи можна отримати знижку при резервуванні?
Так! Наш сервіс дає можливість економити до 30% вартості від фактичної ціни в аптеці на ті товари, на які передбачена знижка. Сума знижки вказується при оформленні броні.
-
Як оплатити і отримати своє замовлення?
Оплата і отримання товару здійснюється тільки в аптеці за адресою, який був обраний при бронюванні товару. Моя Аптека дає можливість кожному економити гроші і час на покупці ліків.
Сайт mypharmacy.com.ua не надає послуг по доставці/відправленні товарів
Економте до 30% при бронюванні товарів в аптеках.
Бретаріс Дженуейр пор. д/інг. 322 мкг/доза інгалятор 60 доз №3

Основна інформація
Інгаляції
рецептурний
Інструкція для Бретаріс Дженуейр пор. д/інг. 322 мкг/доза інгалятор 60 доз №3
- Склад
- Показання
- Протипоказання
- Спосіб застосування та дози
- Побічні реакції
- Передозування
- Застосування у період вагітності або годування груддю
- Умови зберігання
- Реєстраційні данні
Склад
діюча речовина: aclidinium bromide;
1 доза, що вивільняється (доза, що виходить із мундштука), містить 375 мкг аклідинію броміду, що еквівалентно 322 мкг аклідинію. Це відповідає відміряній дозі в 400 мкг аклідинію броміду, що відповідає 343 мкг аклідинію;
допоміжна речовина: лактоза моногідрат.
Лікарська форма
Порошок для інгаляцій.
Основні фізико-хімічні властивості: білий або майже білий дрібнозернистий сипучий порошок, без видимих агломератів або сторонніх включень.
Фармакотерапевтична група
Антихолінергічні препарати. Код АТХ R03B B05.
Фармакологічні властивості
Фармакодинаміка.
Аклідинію бромід є конкурентним, селективним антагоністом мускаринових рецепторів (антихолінергічним засобом), з більш тривалим часом утримання на М3-рецепторах, ніж на М2-рецепторах. М3-рецептори служать посередниками під час скорочення гладкої мускулатури дихальних шляхів. Вдихуваний аклідинію бромід діє місцево в легенях як антагоніст М3-рецепторів гладкої мускулатури дихальних шляхів і викликає розширення бронхів. Доклінічні дослідження in vitro та in vivoпродемонстрували швидке, дозозалежне і тривале інгібування аклідинієм бронхоспазму, викликаного ацетилхоліном. Аклідинію бромід швидко руйнується в плазмі крові, тому кількість системних антихолінергічних побічних реакцій є низькою.
Фармакодинамічна дія
Дослідження клінічної ефективності показали, що Бретаріс® Дженуейр® забезпечує клінічно значиме поліпшення функції легенів (при вимірюванні об’єму форсованого видиху [ОФВ1]) протягом 12 годин після ранкового та вечірнього застосування, що проявлялося протягом 30 хвилин після прийому першої дози (підвищення ОФВ в порівнянні з вихідним рівнем становить 124-133 мл). Максимальне розширення бронхів досягалося протягом 1-3 годин після прийому дози з середнім піком поліпшень ОФВ1 стосовно вихідного рівня 227-268 мл у рівноважному стані.
Електрофізіологія серця
Впливу на інтервал QT (скоректованого методом Фрідеріція або Базетта чи індивідуально скоректованого) не спостерігалося, коли аклідинію бромід (200 мкг або 800 мкг) застосовували здоровим особам один раз на добу протягом 3 днів.
Крім того, клінічно значимих ефектів препарату Бретаріс® Дженуейр® на серцевий ритм при проведенні 24-годинного холтерівського моніторингу після 3 місяців лікування у 336 пацієнтів (164 з яких застосовували Бретаріс® Дженуейр® двічі на добу у дозі 322 мкг) виявлено не було.
Клінічна ефективність
Програма клінічного розвитку фази III включала 269 пацієнтів, які застосовували Бретаріс® Дженуейр® у дозі 322 мкг двічі на день у ході одного 6-місячного рандомізованого дослідження з контролем плацебо, і 190 пацієнтів, які застосовували Бретаріс® Дженуейр® у дозі 322 мкг двічі на добу у ході одного 3-місячного рандомізованого дослідження з контролем плацебо. Ефективність оцінювалася за функцією легень і симптоматичними наслідками, такими як задишка, характерний для захворювання стан здоров’я, застосування препаратів екстреної терапії та наявність загострень. При проведенні довгострокових досліджень безпеки Бретаріс® Дженуейр® продемонстрував бронходилатаційну ефективність протягом більше 1 року.
Бронходилатація
У 6-місячному дослідженні у пацієнтів, що застосовували Бретаріс® Дженуейр® у дозі 322 мкг двічі на день, мало місце клінічно значиме поліпшення функції легень (виміряне за допомогою ОФВ1). Максимальна бронходилатаційна дія проявлялася з першого дня та підсилювалася протягом 6-місячного періоду лікування. Після 6 місяців терапії середнє поліпшення перед прийомом ранкової дози (мінімум) ОФВ1 у порівнянні з плацебо склало 128 мл (95 % СІ=85?170; p < 0,0001).
Подібні спостереження були зроблені для Бретаріс® Дженуейр® під час проведення 3-місячних досліджень.
Бретаріс® Дженуейр® забезпечував клінічно значиме зменшення задишки (оцінене за допомогою динамічного індексу задишки [TDI]) з покращенням TDI після 6-місячного лікування порівняно із 1,0 одиницею плацебо (p < 0,001).
Відсоток пацієнтів із клінічно значущим поліпшенням TDI (визначається як збільшення щонайменше на 1 одиницю зміни TDI) був вищий у групі Бретаріс® Дженуейр® порівняно із плацебо (56,9 % порівняно з 45,5 %; р=0,004).
Бретаріс® Дженуейр® продемонстрував клінічно значиме послаблення симптомів, із поліпшенням загальних показників у порівнянні із плацебо – 4,6 одиниці (p < 0,0001). Відсоток пацієнтів, які досягли клінічно значущого поліпшення в порівнянні з вихідним рівнем був вищий у групі Бретаріс® Дженуейр®порівняно із плацебо (57,3 % порівняно з 41,0 % відповідно; р < 0,001).
Пацієнтам, які застосовували Бретаріс® Дженуейр®, було потрібно менше препаратів екстреної терапії, ніж пацієнтам, які застосовували плацебо (зниження на 0,95 впорскувань на день за 6 місяців [p=0,005]). Бретаріс® Дженуейр® також поліпшував денну симптоматику хронічного обструктивного захворювання легень (ХОЗЛ) (диспное, кашель і вироблення мокротиння), а також нічну та ранню ранкову симптоматику.
Пуловий аналіз ефективності 6-місячних і 3-місячних досліджень із контролем плацебо продемонстрував значне поліпшення частоти помірних і тяжких загострень (що потребують терапії антибіотиками чи кортикостероїдами або закінчуються госпіталізацією) при застосуванні 322 мкг аклідинію двічі на добу у порівнянні з плацебо.
Толерантність до фізичних навантажень
У 3-тижневому перехресному, рандомізованому, плацебо-контрольованому клінічному дослідженні застосування препарату Бретаріс® Дженуейр® було пов'язано зі статистично значущим поліпшенням витривалості фізичних навантажень у порівнянні з 58 секундами при застосуванні плацебо. Бретаріс®Дженуейр® статистично значно знижував гіперінфляцію легень в стані спокою, а також збільшував об’єм вдиху та знижував задишку під час вправ.
Фармакокінетика.
Всмоктування
Аклідинію бромід швидко всмоктується з легенів, досягаючи максимальної концентрації в плазмі крові протягом 5 хвилин після інгаляції у здорових суб’єктів і звичайно протягом перших 15 хвилин у пацієнтів з ХОЗЛ. Фракція інгальованої дози, що досягла системної циркуляції у вигляді незміненого аклідинію, була дуже низькою, менш ніж 5 %.
Пікова концентрація в плазмі крові, досягнута після інгаляції сухого порошку в пацієнтів з ХОЗЛ при однократній дозі 400 мкг аклідинію броміду, склала приблизно 80 пг/мл. Рівноважний рівень у плазмі крові був досягнутий протягом 7 днів при застосуванні двічі на добу і, з огляду на короткий період напіввиведення, рівноважний рівень може бути досягнутий незабаром після застосування першої дози. Нагромадження при повторному застосуванні при рівноважному рівні не спостерігалося.
Розподіл
Загальна кількість аклідинію броміду, інгальованого через інгалятор Бретаріс® Дженуейр®, що потрапляє в легені, склала приблизно 30 % відміряної дози.
Зв’язування аклідинію броміду з білками плазми крові in vitro відповідає, швидше за все, зв’язуванню метаболітів з білками у зв’язку зі швидким гідролізом аклідинію броміду в плазмі крові, зв’язування з білками плазми крові становило 87 % для метаболіту карбонової кислоти та 15 % для спиртового метаболіту. Основним білком плазми крові, що зв’язує аклідинію бромід, є альбумін.
Біотрансформація
Аклідинію бромід швидко й активно гідролізується до своїх фармакологічно неактивних спиртових дериватів і дериватів карбонової кислоти. Відбувається як хімічний гідроліз (не ферментативний), так і ферментативний, за участю естераз, основною естеразою, залученою в гідроліз у людини, є бутирилхолінестераза. Рівень кислотного метаболіту в плазмі крові після інгаляції приблизно в 100 разів вищий, ніж рівень спиртового метаболіту та незміненої діючої речовини. Низька абсолютна біодоступность аклідинію броміду при інгаляційному введенні (< 5 %) пов’язана з тим, що аклідинію бромід піддається активному системному та пресистемному гідролізу як у легенях, так і при застосуванні всередину. Біотрансформація за участю ферментів CYP450 відіграє незначну роль у загальному метаболічному кліренсі аклідинію броміду.
Випробування in vitro показали, що аклідинію бромід у терапевтичній дозі або його метаболіти не пригнічують і не індукують жодні ферменти цитохрому P450 (CYP450) і не пригнічують активність естераз (карбоксилестерази, ацетилхолінестерази та бутирилхолінестерази). Випробування in vitroпоказали, що аклідинію бромід або його метаболіти не є субстратами або інгібіторами глікопротеїну Р.
Виведення
Кінцевий період напіввиведення аклідинію броміду становить близько 2-3 годин.
Після внутрішньовенного введення здоровим випробовуваним особам 400 мкг міченого радіоактивною міткою аклідинію броміду близько 1% дози виводилося в незміненому вигляді з сечею. До 65% дози виводилося у вигляді метаболітів із сечею й до 33% у вигляді метаболітів з фекаліями.
Після інгаляційного введення здоровим особам та пацієнтам з ХОЗЛ 200 мкг і 400 мкг аклідинію броміду дуже мала кількість, близько 0,1% прийнятої дози, виводилася в
незміненому вигляді з сечею, що вказує на те, що нирковий кліренс відіграє незначну роль у загальному кліренсі аклідинію з плазми крові.
Лінійність/нелінійність
Аклідинію бромід у терапевтичному діапазоні продемонстрував наявність кінетичної лінійності та незалежної від часу фармакокінетики.
Фармакокінетичне/фармакодинамічне співвідношення
Зважаючи на те, що аклідинію бромід має місцеву дію в легенях і швидко руйнується в плазмі крові, прямого співвідношення між фармакокінетикою та фармакодинамікою немає.
Особливі групи пацієнтів
Пацієнти з порушенням функції печінки
У пацієнтів із порушенням функції печінки випробування не проводилися. Оскільки аклідинію бромід метаболізується в основному шляхом хімічного та ферментативного розщеплення в плазмі крові, дуже малоймовірно, що порушення функції печінки змінюють його системний вплив. Для пацієнтів з ХОЗЛ і порушенням функції печінки корекція дози не потрібна.
Пацієнти літнього віку
Фармакокінетичні властивості аклідинію броміду в пацієнтів з ХОЗЛ від помірного до тяжкого ступеня є аналогічними таким у пацієнтів віком 40-59 років і пацієнтів віком понад 70 років. Тому для пацієнтів літнього віку з ХОЗЛ корекція дози не потрібна.
Пацієнти з порушенням функції нирок
У пацієнтів із нормальною функцією нирок та з її порушенням значимих розходжень у фармакокінетиці виявлено не було. Тому для пацієнтів з ХОЗЛ і порушенням функції нирок корекція дози та додаткове спостереження не потрібні.
Показання
Підтримувальна бронходилатаційна терапія з метою полегшення симптомів хронічного обструктивного захворювання легень (ХОЗЛ) у дорослих пацієнтів.
Протипоказання
Гіперчутливість до аклідинію броміду, атропіну чи його дериватів, включаючи іпратропій, окситропій, тіотропій, або до допоміжних речовин.
Рідкісні спадкові захворювання, пов’язані з непереносимістю галактози, вродженою недостатністю лактази або порушенням всмоктування глюкози/галактози.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Сумісне застосування аклідинію броміду з іншими антихолінергічними лікарськими засобами не рекомендується, тому що воно не вивчене. Хоча формальні дослідження лікарської взаємодії in vivo не проводилися, аклідинію бромід у вигляді інгаляцій застосовували разом з іншими лікарськими засобами для терапії ХОЗЛ, включаючи бронходилататори – симпатоміметики, метилксантини та стероїди у вигляді інгаляцій і для прийому внутрішньо, причому клінічних ознак лікарської взаємодії виявлено не було. Дослідження in vitro продемонстрували, що аклідинію бромід у терапевтичній дозі або його метаболіти не взаємодіють із лікарськими засобами, що є субстратами глікопротеїну Р (P-gp), та лікарськими засобами, які метаболізуються ферментами цитохрому Р450 (CYP450) та естеразами.
Особливості застосування
Бронхіальна астма
Бретаріс® Дженуейр® не можна застосовувати при бронхіальній астмі, тому що клінічні випробування аклідинію броміду при астмі не проводилися.
Парадоксальний бронхоспазм
Як і під час іншої інгаляційної терапії, застосування препарату Бретаріс® Дженуейр® може викликати парадоксальний бронхоспазм. Якщо це сталося, то лікування препаратом Бретаріс® Дженуейр®необхідно припинити та розглянути можливість альтернативної терапії.
Погіршення перебігу захворювання
Аклідинію бромід є підтримувальним бронходилататором і його не слід застосовувати для усунення гострих нападів бронхоспазму, тобто як препарат екстреної терапії. Якщо під час лікування аклідинію бромідом у пацієнта відбулася така зміна вираження симптомів ХОЗЛ, що він вважає за необхідне проведення додаткової екстреної терапії, потрібно провести повторну оцінку стану пацієнта і його режиму лікування.
Вплив на серцево-судинну систему
Профіль безпеки відносно серцево-судинної системи характеризується наявністю антихолінергічної дії.
Бретаріс® Дженуейр® потрібно застосовувати з обережністю пацієнтам, які перенесли інфаркт міокарда в попередні 6 місяців, пацієнтам з нестабільною стенокардією, вперше діагностованою аритмією в попередні 3 місяці та пацієнтам, які були госпіталізовані з приводу серцевої недостатності III і IV функціональних класів за класифікацією Нью-Йоркської кардіологічної асоціації в попередні 12 місяців. Такі пацієнти були виключені з клінічних випробувань, і перебіг цих захворювань може бути погіршений при застосуванні аклідинію через антихолінергічний механізм дії.
Антихолінергічна дія
Сухість у роті, що спостерігається при лікуванні препаратами з антихолінергічною дією, при їхньому тривалому застосуванні може бути пов’язана з виникненням карієсу зубів.
З огляду на антихолінергічну дію аклідинію бромід, потрібно з обережністю застосовувати пацієнтам із симптоматичною гіперплазією передміхурової залози, контрактурою шийки сечового міхура або з закритокутовою глаукомою (незважаючи на те, що прямий контакт препарату з очима дуже малоймовірний).
Допоміжні речовини
Кожна відміряна доза містить 12,6 мг лактози моногідрату.
Спосіб застосування та дози
Для інгаляцій.
Пацієнти повинні бути проінструктовані щодо правильного застосування лікарського засобу.
Рекомендована доза ? 1 інгаляція 322 мкг аклідинію 2 рази на день.
У разі пропуску прийому дози наступну дозу необхідно застосувати якомога швидше. Однак у випадку, якщо час для прийому наступної дози майже підійшов, пропущену дозу застосовувати не слід.
Пацієнти літнього віку
Пацієнтам літнього віку корекція дози не потрібна.
Порушення функції нирок
Пацієнтам із порушеннями функції нирок корекція дози не потрібна.
Порушення функції печінки
Пацієнтам із порушеннями функції печінки корекція дози не потрібна.
Інгалятор білого кольору із вбудованим індикатором доз та зеленою дозувальною кнопкою. Мундштук покритий знімним захисним ковпачком. Інгалятор знаходиться у пластиковому ламінованому пакеті, упакований у картонну коробку.
Інструкція із застосування
Ознайомлення з Бретаріс® Дженуейр®
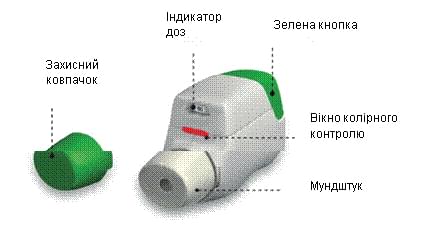
Дістаньте інгалятор Дженуейр® із пакета і ознайомтеся з його компонентами.
Як використовувати Бретаріс® Дженуейр®
Для використання інгалятора Дженуейр® після зняття ковпачка Вам необхідно зробити 2 кроки:
Крок 1. Натиснути й ВІДПУСТИТИ зелену кнопку і повністю видихнути, але не в інгалятор.
Крок 2. Щільно обхопити губами мундштук і СИЛЬНО й ГЛИБОКО вдихнути через інгалятор.
Після інгаляції не забудьте надягти захисний ковпачок.
Початок
- Перед першим застосуванням розірвіть закритий пакетик уздовж мітки й вийміть інгалятор Дженуейр®.
- Коли Ви збираєтеся прийняти дозу лікарського препарату, зніміть захисний ковпачок, для чого злегка стисніть стрілки на кожному боці й потягніть назовні (див. рисунок 1).

- Переконайтеся в тому, що мундштук ніщо не блокує.
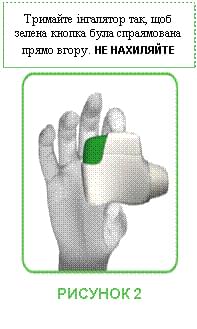
- Тримайте інгалятор Дженуейр® горизонтально, мундштуком до себе, щоб зелена кнопка була спрямована прямо вгору (див. рисунок 2).
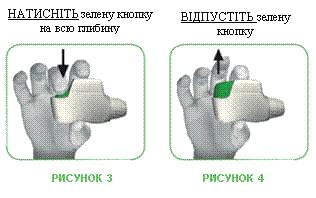
КРОК 1. Натисніть зелену кнопку на всю глибину, потім ВІДПУСТІТЬ її (див. рисунок 3 та 4).
НЕ УТРИМУЙТЕ ЗЕЛЕНУ КНОПКУ НАТИСНУТОЮ.
Зупиніться й перевірте: переконайтеся, що доза готова для інгаляції
- Переконайтеся, що вікно колірного контролю стало зеленим (див. рисунок 5).
- Зелений колір контрольного вікна підтверджує, що лікарський препарат готовий для інгаляції.

ЯКЩО ВІКНО КОЛІРНОГО КОНТРОЛЮ ЗАЛИШАЄТЬСЯ ЧЕРВОНИМ, НАТИСНІТЬ І ВІДПУСТІТЬ ЩЕ РАЗ (ДИВ. КРОК 1).
- Перед тим, як піднести інгалятор до рота, повністю видихніть. Не видихайте в інгалятор.
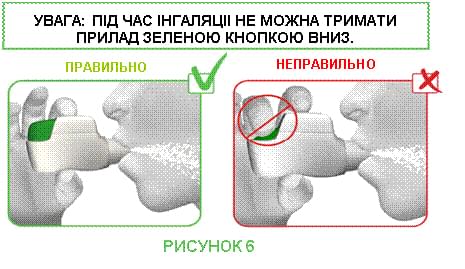
КРОК 2. Щільно обхопіть губами мундштук інгалятора Дженуейр® і СИЛЬНО й ГЛИБОКО вдихніть через рот (див. рисунок 6).
Такий сильний, глибокий вдих доставляє лікарський препарат через інгалятор у легені.
- Під час вдиху Ви почуєте КЛАЦАННЯ, що означає правильне використання інгалятора Дженуейр®.
- Щоб переконатися в тому, що Ви прийняли всю дозу, продовжуйте дихати, навіть після того, як почули КЛАЦАННЯ інгалятора.
- Заберіть інгалятор Дженуейр® від рота й затримайте подих так довго, як ви можете, щоб було комфортно, потім повільно видихніть через ніс.
Примітка: деякі пацієнти можуть відчувати легкий присмак при інгаляції цього лікарського препарату. Не приймайте додаткову дозу, якщо Ви не відчули ніякого смаку після інгаляції.
Зупиніться й перевірте: переконайтеся, що Ви правильно провели інгаляцію
- Переконайтеся, що вікно контролю стало червоним (див. рисунок 7). Це підтверджує те, що Ви правильно провели інгаляцію повної дози. Не застосовуйте додаткову дозу, якщо Ви нічого не відчули після інгаляції.

ЯКЩО ВІКНО КОЛІРНОГО КОНТРОЛЮ ЗАЛИШАЄТЬСЯ ЗЕЛЕНИМ, НЕОБХІДНО ЗНОВУ СИЛЬНО Й ГЛИБОКО ВДИХНУТИ ЧЕРЕЗ МУНДШТУК (ДИВ. КРОК 2).
- Якщо вікно все ще не змінює свій колір на червоний, то можливо, що Ви могли забути відпустити зелену кнопку перед інгаляцією або могли неправильно вдихнути. Якщо це так, спробуйте знову.
Переконайтеся, що Ви ВІДПУСТИЛИ зелену кнопку, й зробіть СИЛЬНИЙ глибокий вдих через мундштук.
Примітка: якщо після кількох спроб Вам так і не вдалося правильно провести інгаляцію, зверніться до лікаря.
- Як тільки вікно стало червоним, надягніть захисний ковпачок назад на мундштук (див. рисунок 8).
Коли Вам необхідний новий інгалятор Дженуейр®?
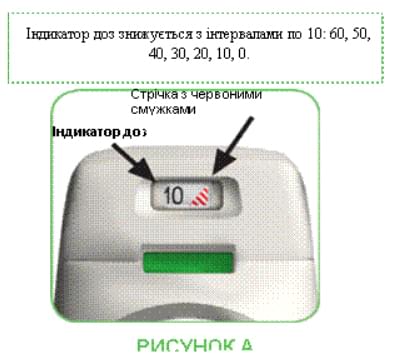
- Інгалятор Дженуейр® обладнаний індикатором доз, що показує, скільки приблизно доз залишилося в інгаляторі. Індикатор доз повільно опускається, показуючи інтервали до 10 (60, 50, 40, 30, 20, 10, 0) для форми випуску 60 доз та 30, 20, 10, 0 для форми випуску 30 доз (див. рисунок А). Кожен інгалятор Дженуейр® містить 30 або 60 доз (див. розділ «Упаковка»).
- Коли на індикаторі доз з’явиться стрічка з червоними смужками (див. рисунок А), це означає, що Ви наближаєтеся до останньої дози, і необхідно придбати новий інгалятор Дженуейр®.
Примітка: якщо Ваш інгалятор Дженуейр® виявиться пошкодженим або якщо Ви втратили ковпачок, необхідно замінити інгалятор. Інгалятор Дженуейр® чистити НЕ ПОТРІБНО. Однак, якщо Вам захочеться його почистити, це треба робити за допомогою сухої тканини або паперової серветки зовні мундштука. НІКОЛИ не використовуйте воду для чищення інгалятора Дженуейр®, бо це може пошкодити лікарський препарат.
Як довідатися, що Ваш інгалятор Дженуейр® порожній?
- Коли всередині індикатора доз з’явиться 0 (нуль), необхідно продовжити використання всіх доз, що залишаються в інгаляторі Дженуейр®.
- Коли для інгаляції буде підготовлена остання доза, зелена кнопка не повернеться повністю у своє верхнє положення, а залишиться заблокованою в середньому положенні (див. рисунок В). Навіть коли зелена кнопка заблокована, Ви, проте, зможете прийняти останню дозу. Після цього інгалятор Дженуейр® не може бути використаний знову, і Вам необхідно буде почати використовувати новий інгалятор Дженуейр®.

Діти.
Лікарський засіб Бретаріс® Дженуейр® не рекомендується застосовувати дітям (віком до 18 років) у зв’язку з відсутністю достатнього клінічного досвіду.
Побічні реакції
Побічними реакціями, що найчастіше зустрічаються при застосуванні Бретаріс® Дженуейр®, є головний біль (6,6 %) і назофарингіти (5,5 %).
Частоту наведених нижче побічних реакцій, встановлено за загальними коефіцієнтами виникнення побічних реакцій (тобто реакцій, що виникають у зв’язку із застосуванням препарату Бретаріс®Дженуейр®). Ці реакції спостерігалися під час застосування препарату Бретаріс® Дженуейр® у дозі 322 мкг (636 пацієнтів) в одному 6-місячному та двох 3-місячних рандомізованих клінічних випробуваннях із контролем плацебо.
Частота побічних реакцій визначена в такий спосіб: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), нечасто (від ≥ 1/1000 до < 1/100), рідко (від 1/10 000 до < 1/1000), дуже рідко (< 1/10 000); частота невідома (частоту не можна оцінити, виходячи з наявних даних).
|
Класи системи органів |
Побічні реакції |
Частота |
|
Інфекції та паразитарні захворювання |
Синусити |
Часто |
|
Назофарингіти |
Часто |
|
|
З боку імунної системи |
Реакції гіперчутливості |
Рідко |
|
Ангіоедема |
Частота невідома |
|
|
З боку нервової системи |
Головний біль |
Часто |
|
Запаморочення |
Нечасто |
|
|
З боку органів зору |
Розмитість зору |
Нечасто |
|
З боку серцево-судинної системи |
Тахікардія |
Нечасто |
|
Серцебиття |
Нечасто |
|
|
З боку органів дихання, грудної клітки та середостіння |
Кашель |
Часто |
|
Дисфонія |
Нечасто |
|
|
З боку травної системи |
Діарея |
Часто |
|
Нудота* |
Часто |
|
|
Сухість у роті |
Нечасто |
|
|
Стоматити |
Нечасто |
|
|
З боку шкіри та підшкірної тканини |
Висип |
Нечасто |
|
Свербіж |
Нечасто |
|
|
З боку нирок та сечовивідних шляхів |
Затримка сечі |
Нечасто |
* Частота виникнення нудоти в ході клінічних досліджень була нижчою при застосуванні аклідинію порівняно з плацебо (43,9 проти 48,3 на 1000 пацієнто-років відповідно).
Доклінічні дані з безпеки
У доклінічних даних з безпеки, що ґрунтуються на традиційних фармакологічних дослідженнях безпеки, токсичності при багаторазовому застосуванні, генотоксичності, канцерогенної дії та репродуктивної токсичності особливих ризиків для людини не виявлено. При проведенні доклінічних досліджень ефекти відносно параметрів серцево-судинної системи (збільшення частоти серцевих скорочень у собак), репродуктивної токсичності (фетотоксична дія) та фертильності (невелике зниження частоти зачать, кількості жовтих тіл і пре- та постімплантаційна загибель ембріонів) спостерігалися тільки при значеннях експозиції, що значно перевищують максимальний вплив на людину, що вказує на невелику значимість для клінічного застосування. Низька токсичність, виявлена при проведенні доклінічних досліджень токсичності, частково обумовлена швидкістю метаболізму аклідинію броміду в плазмі та відсутністю значимої фармакологічної активності більшості метаболітів. Діапазон безпеки для людини при системній експозиції, що становить 400 мкг два рази 3 на добу в цих випробуваннях варіює від 17 до 187-кратного значення максимальної дози препарату, що не призводить до розвитку спостережуваних побічних дій.
Передозування
Високі дози аклідинію броміду можуть спричинити ознаки і симптоми антихолінергічної дії. Однак одноразова інгаляційна доза аклідинію броміду до 6000 мкг у здорових осіб не призводила до системних побічних антихолінергічних дій. Крім того, клінічно значимі побічні дії після 7-денного застосування аклідинію броміду до 800 мкг двічі на день у здорових осіб не спостерігалися.
Розвиток гострої інтоксикації при випадковому застосуванні аклідинію броміду є малоймовірним через низьку біодоступность при внутрішньому застосуванні та інгаляційний механізм дозування інгалятора Дженуейр®.
Застосування у період вагітності або годування груддю
Вагітність
Даних щодо застосування аклідинію броміду вагітним жінкам немає.
Дослідження на тваринах продемонстрували токсичну дію на плід тільки в дозах, що сильно перевищують максимальну концентрацію аклідинію броміду в людини. Аклідинію бромід можна застосовувати під час вагітності тільки в тому випадку, якщо очікувана користь перевершує потенційний ризик.
Годування груддю
Невідомо, чи проникає аклідинію бромід і його метаболіти в грудне молоко в жінок. Оскільки дослідження на тваринах показали, що невеликі кількості аклідинію броміду і його метаболітів проникають у молоко, то необхідно прийняти рішення щодо припинення грудного вигодовування або про припинення терапії аклідинію бромідом, з огляду на користь грудного вигодовування для дитини та користь тривалої терапії аклідинію бромідом для жінки.
Фертильність
Дослідження на тваринах продемонстрували невелике зниження фертильності тільки в дозах, що сильно перевищують максимальну концентрацію аклідинію броміду в людини. Вважається малоймовірним, що аклідинію бромід, призначений у рекомендованій дозі, впливає на фертильність у людини.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами. Аклідинію бромід не впливає або незначно впливає на швидкість реакції при керуванні автотранспортом чи іншими механізмами. Виникнення головного болю чи розмитості зору може впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Умови зберігання
Термін придатності
3 роки.
Використати протягом 90 днів з моменту відкриття.
Умови зберігання
Спеціальні умови зберігання не вимагаються. Інгалятор Дженуейр® слід зберігати в оригінальній упаковці до початку використання. Зберігати в недоступному для дітей місці.
Упаковка
По 30 доз порошку для інгаляцій в інгаляторі, по 1 інгалятору в пластиковому пакеті в коробці з картону; по 60 доз порошку для інгаляцій в інгаляторі, по 1 або по 3 інгалятори в пластиковому пакеті кожен у коробці з картону.
Категорія відпуску
За рецептом.
Реєстраційні данні
Інструкція для: Бретаріс Дженуейр пор. д/інг. 322 мкг/доза інгалятор 60 доз №3
Виробник: Індастріас Фармасеутікас Алмірал С.А., Іспанія
Фарм. група: Антихолінергічні препарати.
Реєстрація: UA/15568/01/01
МНН: Aclidinium bromide
Код АТХ:
(R) Лікарські засоби для лікування захворювань дихальної системи
(R03) Препарати для лікування бронхіальної астми
(R03B) Інші препарати для інгаляційного застосування для лікування бронхіальної астми
(R03BB) Холіноблокатори
(R03BB05) Аклідинію бромід





Відгук про Бретаріс Дженуейр пор. д/інг. 322 мкг/доза інгалятор 60 доз №3
Цей товар ще не має відгуків